Research研究内容
蛋白質は20種類のアミノ酸がペプチド結合で結合した1本の長い生体高分子です。そのアミノ酸配列というプログラムに従って、自発的に決まった立体構造を取り、センサーであったり、モーターであったり、おおよそ人間が考えうるあらゆる機能を持つ機械として働きます。
それらナノサイズの分子機械がどのように立体構造を取っており、どのようなメカニズムで機能を発揮するかを明らかにするために、クライオ電子顕微鏡(クライオ電顕)を使った構造解析を行っています。
分子モーターの作動メカニズムの解析
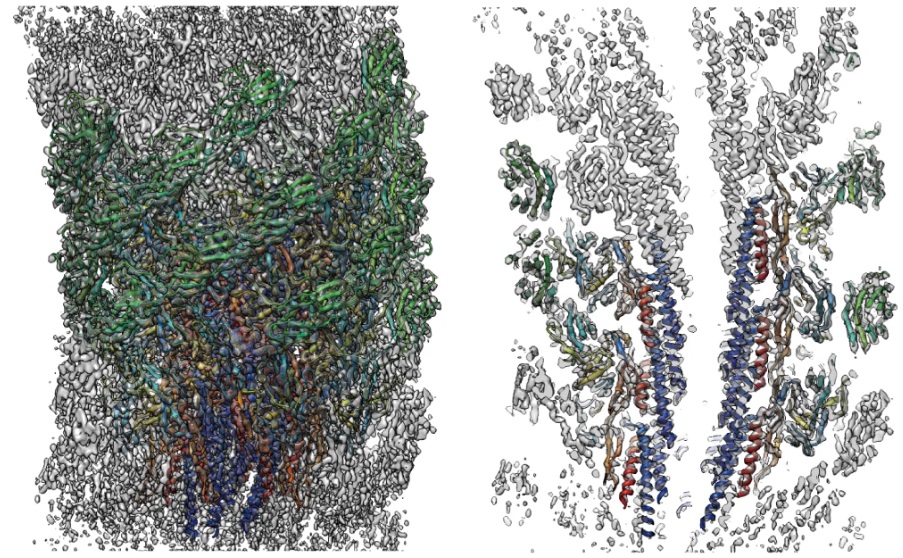
図1:べん毛フックの構造
べん毛は曲がった状態が機能状態であり、この形のまま構造解析ができる手法はクライオ電子顕微鏡しかない。
嗅覚受容体の構造解析
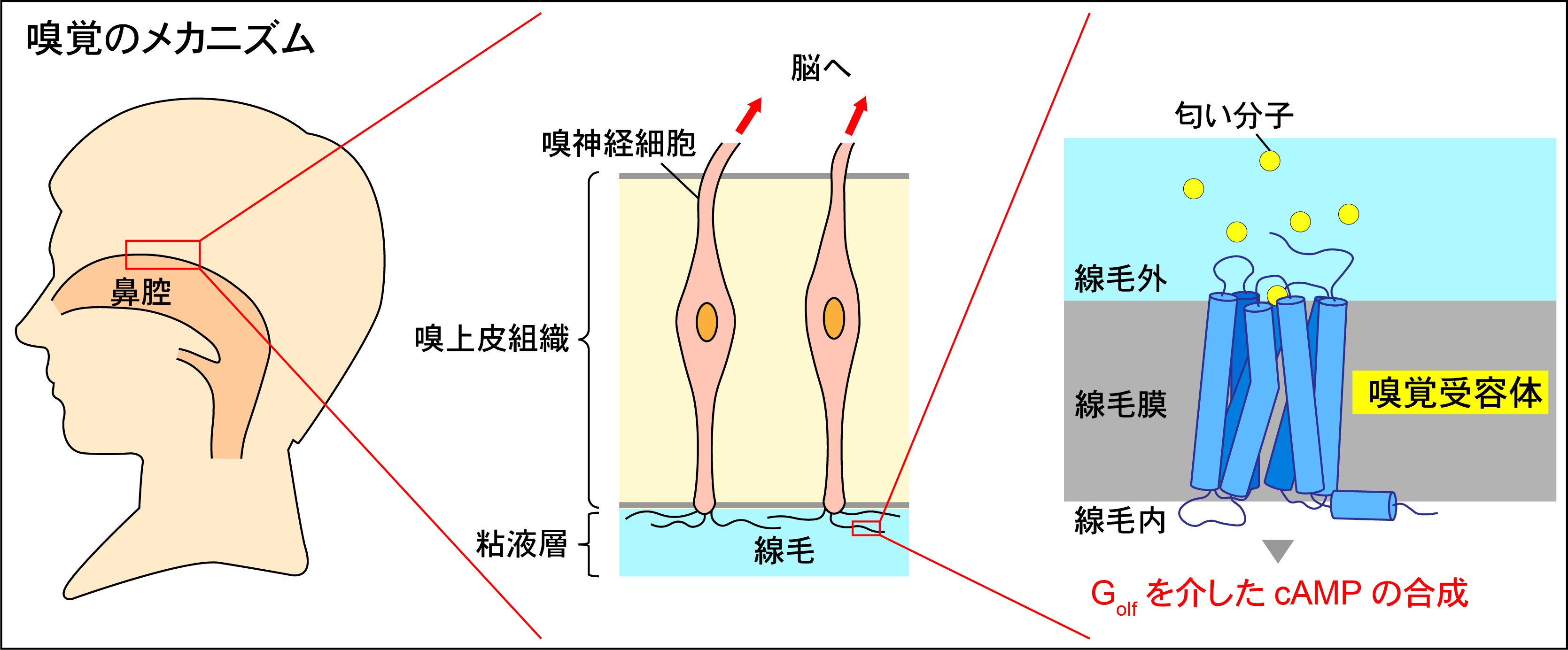
図2:嗅覚のメカニズム 提供 中村祥大さん
クライオ電子顕微鏡撮影法及び解析法の開発

図3 左:Titan Krios 右:Talos Arctica
蛋白質研究所には世界最高レベルのクライオ電子顕微鏡とスクリーニング用の電子顕微鏡が1台あり、蛋白質の構造解析をスムーズに行う環境が整っている。
