アミロイド線維の構造解析
正常時は水溶性のタンパク質が何らかの原因で不溶化、重合してファイバー状の巨大構造体(アミロイド線維)を形成して細胞内に蓄積する現象が、アルツハイマー病やクロイツフェルトヤコブ病、長期透析患者に見られるアミロイドーシス病ほか30種以上の疾病の原因に関係することが知られている。これらの線維構造体を形成するタンパク質は、元々は細胞表在性受容体APPや、細胞死の制御に関わるHET、組織適応性抗原β2ミクログロブリン(β2m)と、活動の場もアミノ酸配列も様々であるにもかかわらず、線維の電子顕微鏡観察によると一様によく似た枝分かれのない直線的なファイバー状構造体になっている。またX線線維回折によるといずれもβストランドを線維伸長軸に直角に配向した「クロスβ構造」をとるらしい。したがってアミノ酸配列に起因する分子内の折りたたみではなく分子間の作用に基づく、アミロイド線維特有の超分子構造構築の一般原理があるように見える。これを解明することは関連する多くの疾病の根絶に向けた第一歩になる。そこで近年世界中の研究者が総力を挙げて多くの知見を明らかにしてきたが線維形成の分子メカニズムの全容は依然として明らかになっていない。また疾患とは逆に、「インフラマソーム」に代表される線維状タンパク質重合体が免疫系を含む生命機能に能動的な役割を果たす例も知られており、タンパク質重合体の疾病・機能−構造相関研究の重要性は多岐にわたる。
線維状重合体の構造解析が難しい主な原因は、そもそも研究法の欠如にある。原子分解能の構造解析のためにX線結晶回折法は良質の(3次元的な)単結晶を要求するがアミロイド線維は1次元的な重合体であり、解析できない。線維形成能があるペプチドが作る結晶(飽くまで結晶!)の構造解析は報告されているが、この結晶構造とこれらが作る線維中の分子構造の関連性は不詳である。また線維構造体の有効分子量は数百万を越えることもしばしばで、いわゆる「分子量限界」のために溶液NMRによる解析も不可能である。
そこで固体NMRが登場する。固体NMR法は不溶性、非結晶性の巨大分子の原子分解能の構造解析を行える現在唯一の手段で、近年その方法論はハード、ソフトともに成熟しつつあり、線維状重合体の構造研究に有効である。
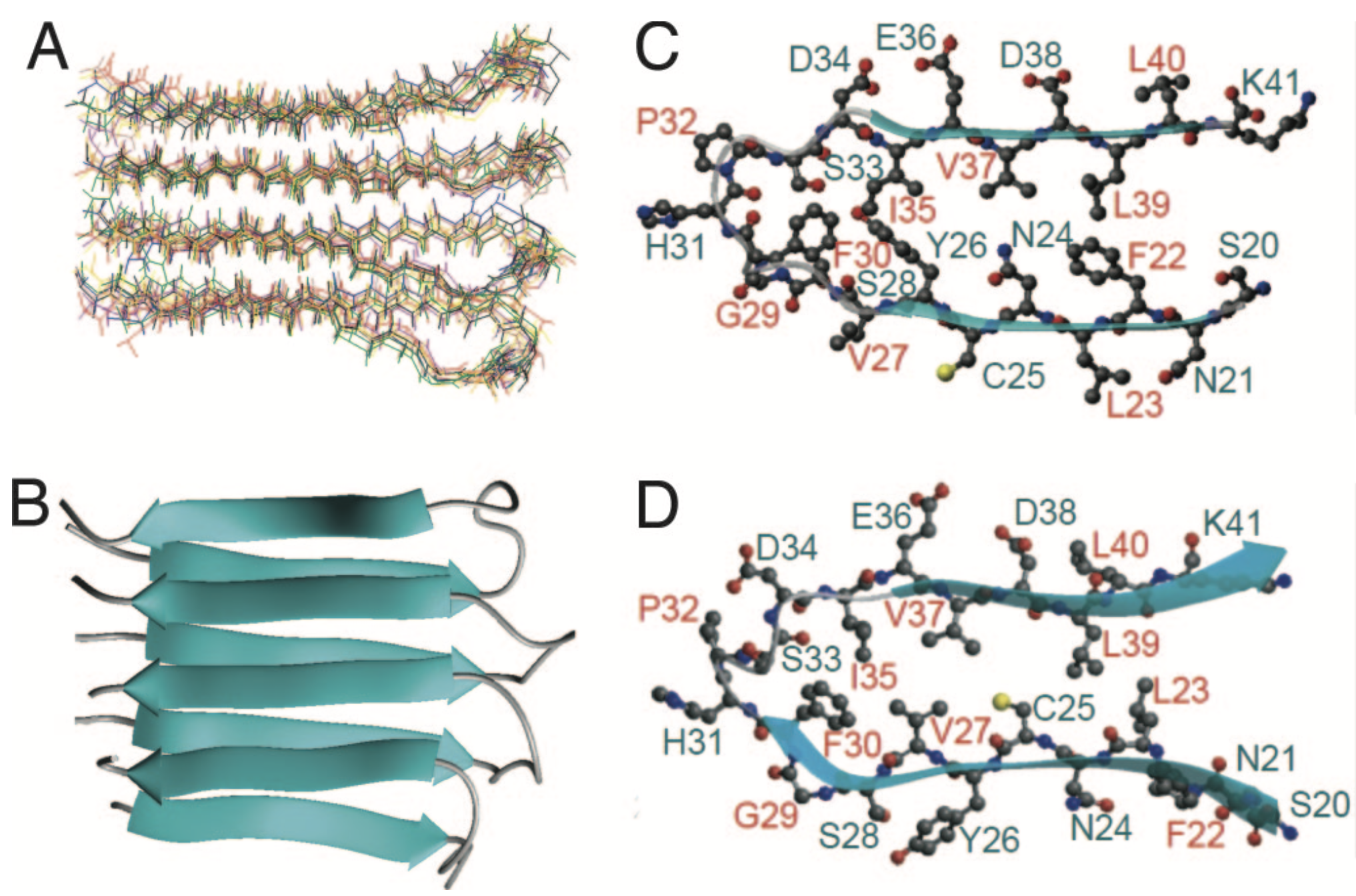
2006年、我々はクラスI 主要組織適合性抗原の断片(22残基)が形成する線維状重合体の完全立体構造決定に成功し、アミロイド疾患の治療法の開発に向け新たな知見を与えた (下図、PNAS, 2006)。これに続き、全長のβ2m(99残基)が作るアミロイド線維の構造解析にも挑戦している。透析アミロイド病患者からの線維試料を用いたex vivo構造解析で、ここでは固体NMRと極低温電子顕微鏡(CryoEM)を併用するマルチスケール解析を進めている。
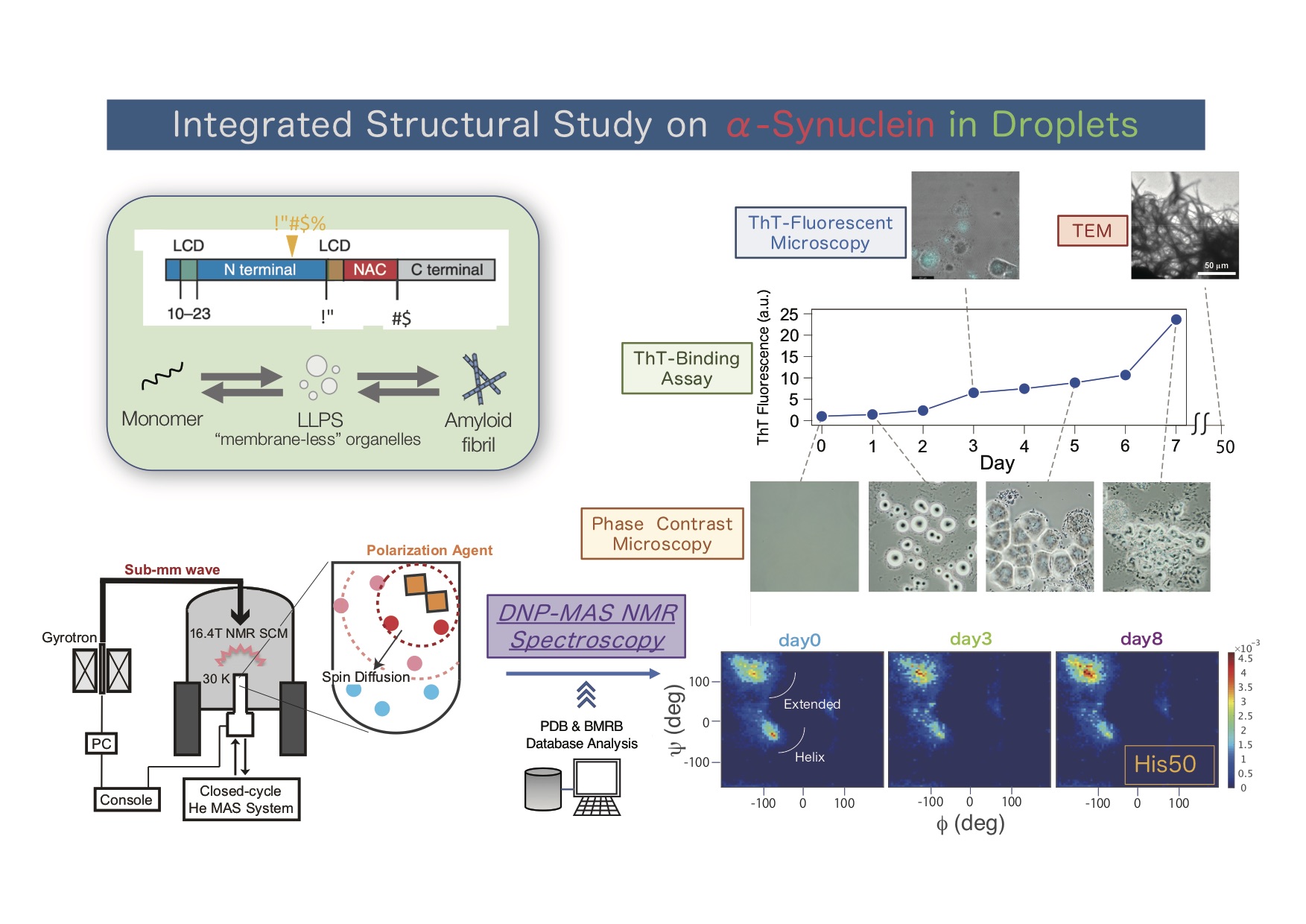
最近は症状や進行性が異なる一連のパーキンソン病患者群から採取したαシヌクレイン線維の比較研究、構造-フェノタイプ相関の研究、線維化以前に起きる液液相分離(LLPS)状態における構造アンサンブルの研究も進めている。特に後者は、一義的な立体構造が定義できない構造アンサンブルの特徴を掘り下げる研究であり、結晶学やクライオ電顕では難しい解析対象である。アンサンブルの新しい構造決定法を作っているし、溶液NMR、超偏極・固体NMR、位相差顕微、蛍光顕微を総動員する多角的な研究手法を開拓している(M. Takamuku et al., Neurosci. Int., 2022)。