細胞まるごと研究
生命の機能はそれを構成する分子の階層的な構造によって維持されており、生細胞内で合成される分子種や分子数、またはその経時変化の定量的な測定や解析は、生命現象を理解する上で必須である。これまで、蛍光顕微鏡や溶液NMRを用いて、細胞内タンパク質の時空間での位置解析や構造解析が行われてきたが、生細胞内の全ての分子を観測し、かつ定量できる手法は存在しなかった。
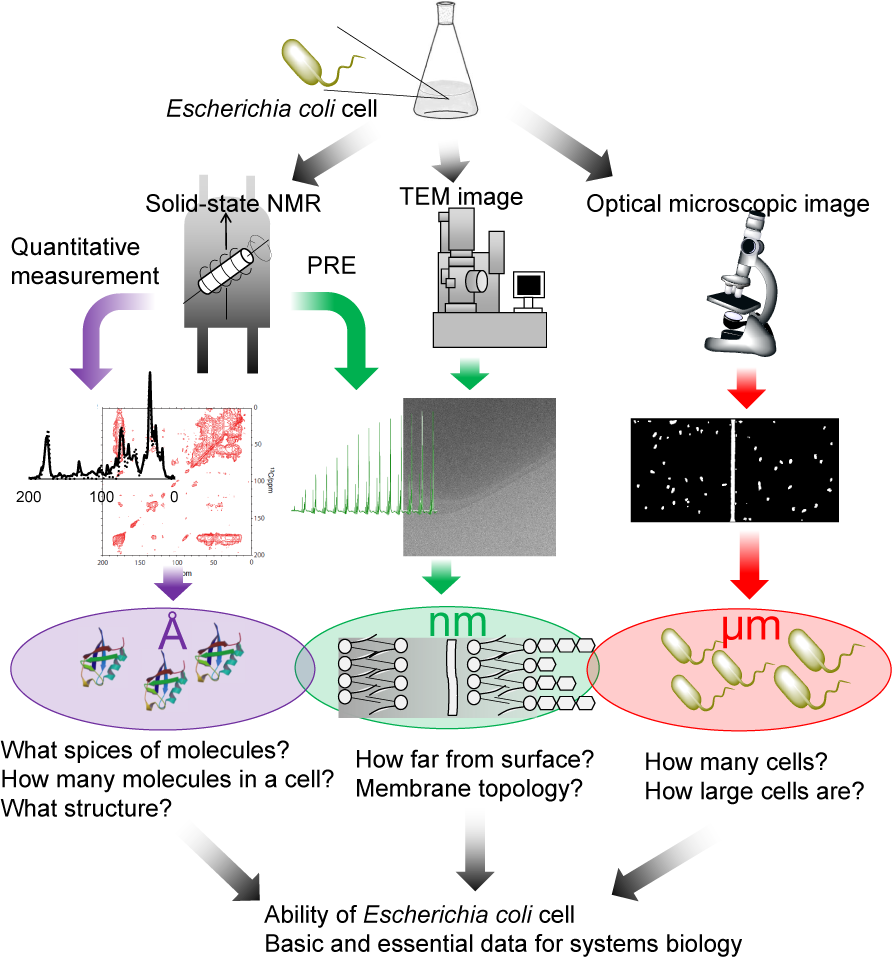
そこで、固体NMRの出番である。固体NMRの1つ目の特徴として、特に低温下では分子の運動性が低い膜タンパク質などの巨大分子複合体も含めて細胞内の全分子の観測が可能であることが言えるだろう。2つ目には、タンパク質や細胞を破壊せずに細胞内部の分子を測定できる非侵襲性が挙げられる。すなわち、細胞が生きている状態を反映したまま内部の情報を得られるのである。最後に、NMRそのものは原理的に定量性があり、純度を測定する定量NMRとしても用いられている。つまり、分子の数とシグナル強度が完全に比例する。これらの特徴を組み合わせれば細胞内分子の定量が可能であるはずであり、生命の機能に迫れるはずである。さらに、固体NMRによる原子分解能の情報と、光学顕微鏡・電子顕微鏡から得られる細胞の高次な情報を組み合わせれば、階層的な構造で形成される細胞に正面から迫ることができるだろう。
定量的な固体NMR測定を用いてどのような生命現象を解明するかということであるが、新しい手法を用いていきなり複雑な人間や動物を測定対象とするのは難しい。従って、我々は大腸菌をモデル生物、ユビキチンの過剰発現をモデル現象とし、固体NMRによる細胞内分子の定量測定の検証を行った。まず、測定した大腸菌のスペクトルと報告されている大腸菌が合成する分子のスペクトルシミュレーションとを比較し、ユビキチンを発現誘導した大腸菌細胞が合成する分子種を明らかにした。続いて、スペクトル面積からスピン数を計数することで、各分子の個数を計数した。
固体NMRによる細胞計測によって得られる情報は、分子数だけでない。一例として、大腸菌細胞内でのタンパク質の構造情報を挙げる。分子数計数法を確立する過程で、我々は大腸菌細胞内のユビキチン由来の信号を抽出することに成功した。その信号の化学シフトとシミュレーションから計算した化学シフトを比較することで、大腸菌細胞内においてユビキチンの構造は試験管内と同様の構造に保たれていることが分かった。また別の例として、細胞内における分子の位置情報取得の例も挙げたい。本研究室では常磁性分子を用いることで細胞の表面と内側を分離して観測することにも成功している。将来的には細胞に作らせた分子が細胞内のどこにいるのかという情報も得られるはずである。
NMRの弱点は、試料全体の平均の情報しか得られないことである。我々は個々の細胞の分布を確かめるため、光学顕微鏡で細胞の大きさの分布や培養中での培地に存在する大腸菌細胞数を計測した。さらに、それらの変化と固体NMRから得られた細胞内分子数の変化が矛盾しないことを示すことができた。このように、固体NMRと顕微鏡の利点を組み合わせることで、大腸菌細胞の本質に迫ることができつつある。
以上の様なデータを得て、一体どのような意義があるのかと思われるかもしれない。例として、大腸菌が合成したユビキチンの細胞内体積に占める割合や、培地1 L当たりの収量が計算できるだろう。リボソームが1秒当たり何分子のユビキチンを合成しているか計算できるかもしれない。また、培地中のグルコース分子をどの程度の速度で取り込み、何パーセントがユビキチンに取り込まれ、何パーセントが二酸化炭素となって放出されるのか計算できるかもしれない。このような知見は、大腸菌の分子の取り込みや合成能力を評価し、大腸菌のシステム生物学を議論するのに必要不可欠なデータとなると考えている。