細胞内蛋白質の構造解析
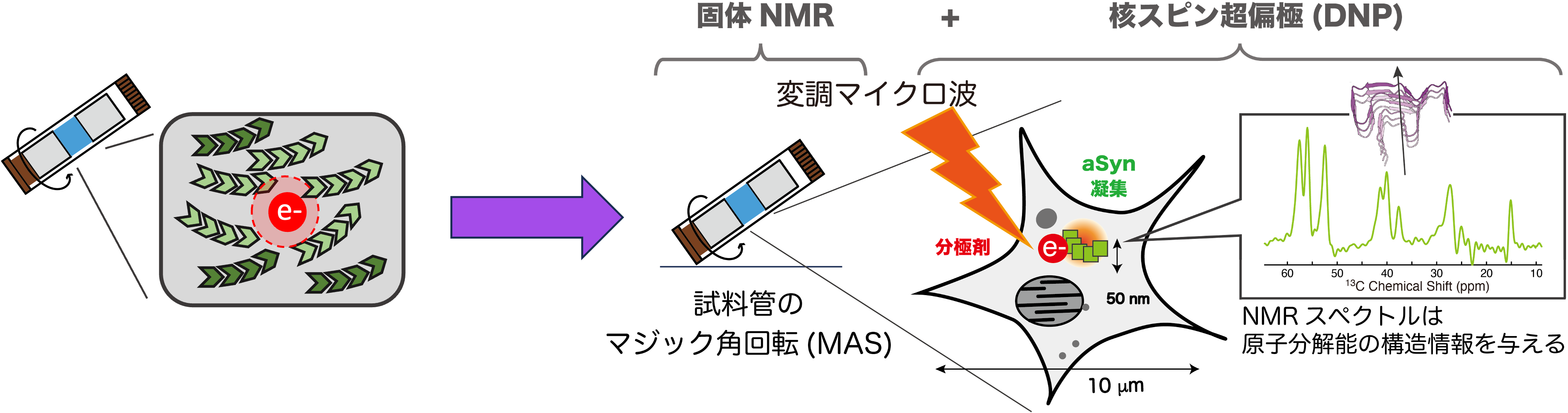
蛋白質凝集・線維の構造研究は固体NMRとクライオ電顕で進んできています。単一蛋白質の凝集体を単離・精製して集め、試料管内あるいはグリッド上で観察し、原子分解能の構造を決定できます(下図、左)。しかし、これで満足ではありません。凝集には多様な高次構造=多型があります。多型の違いが異なる疾患や、病態、病状の進行を引き起こします。
いわゆるアンフィンゼンのドグマに従う「ふつうの」蛋白質と違い、アミノ酸一次配列と多型には決定論的な相関がありませんので、AlphaFoldなど機械学習的な立体構造予測はできません。多型は遺伝子(アミノ酸配列)にコードされておらず細胞内環境が決めるので、生体環境ごとにどの多型ができるのか、多型が生まれる分子機構、多型が細胞内で何をしているか、など多くの謎を解明するには細胞内で直接、実験的に観察するのが大変重要な課題です(下図、右)。
そこで我々は、歴史的に行われてきた「純粋な希薄溶液」や「単分散状態」の蛋白質構造解析から離れ、例えばヒトの神経細胞内で直接、分子構造を決める技術の開発を行っています。われわれは新たに発見したナノダイヤモンド超分極剤を発展させ、超偏極・固体NMRと組み合わせてこれを実現し、その分子機構に迫る基盤情報をえて、解明の糸口をつかもうと努力しています。これは固体NMRにしかできない挑戦といえるでしょう。