固体NMRで何ができるの?
固体NMR法は水に溶けない、単分散も結晶化もできない分子系、精製できない、あるいはしたら意味がない系など、他の方法では構造解析がむずかしい試料を対象に立体構造・運動性の情報を原子分解能で得られる稀な手法です。
私たちはアミロイドとよばれるタンパク質凝集体や、G蛋白質共役受容体(GPCR)に代表される膜タンパク質を標的に固体NMR法で立体構造・運動性の解析、またそれを実現するための技術開発を行っています。これらは創薬に絡んだ実利と同時に、生命の運行原理の解明のための学術研究という二面性をもちあわせています。これは蛋白研の強みとも合致します。高度な技術に支えられた学術研究以外に、国内外の産業界・製薬企業との連携をサポートする体制が古くから備わっています。私たちのラボでは、産業界、製薬企業との共用事業、共同研究も同時進行し、下記の挑戦に両面作戦で取り組んでいます。
タンパク質凝集体
たとえばアルツハイマー病(AD)やパーキンソン病(PD)の原因となるアミロイド線維とよばれる蛋白質凝集体は、とある病原性蛋白質の巨大な重合体ですが、水に溶けず、単結晶にもなりません。絵本スイミーに登場する魚群のように、たくさん集まって様々な高次構造(多型という)を細胞内外に作ります(図1)。多型ごとに細胞毒性や細胞間伝搬の効率が違うので、多型が下流の細胞プロセスを変化させているようです。細胞内では多型を認識する蛋白質が異なるのだと考えられます。どうやって多型が決まるのか、どうやったら形成を阻害できるのか。創薬の上で重要な課題です。AD、PDの他にも多様な脳神経疾患が報告されており、これは世界人口の高齢化に伴って今後20年、人類が立ち向かうべき最大の健康問題となるでしょう。
アミロイド線維・凝集には疾患性のもの以外に、免疫増幅1や長期記憶の固定2など機能性のものも多数あることが分かってきています。凝集性の蛋白質は広い生物種に保存されていますし3,4、ショウジョウバエでは脳神経系の遺伝子に多数見つかります5,6。液液相分離(LLPS)も含め、蛋白質凝集という手段は生命に広く使われてきた道具なのかもしれません。この「蛋白質凝集が司る生理と病理」には分かっていないことが多く、現代の生物学における最大の未解決問題の一つといえます。
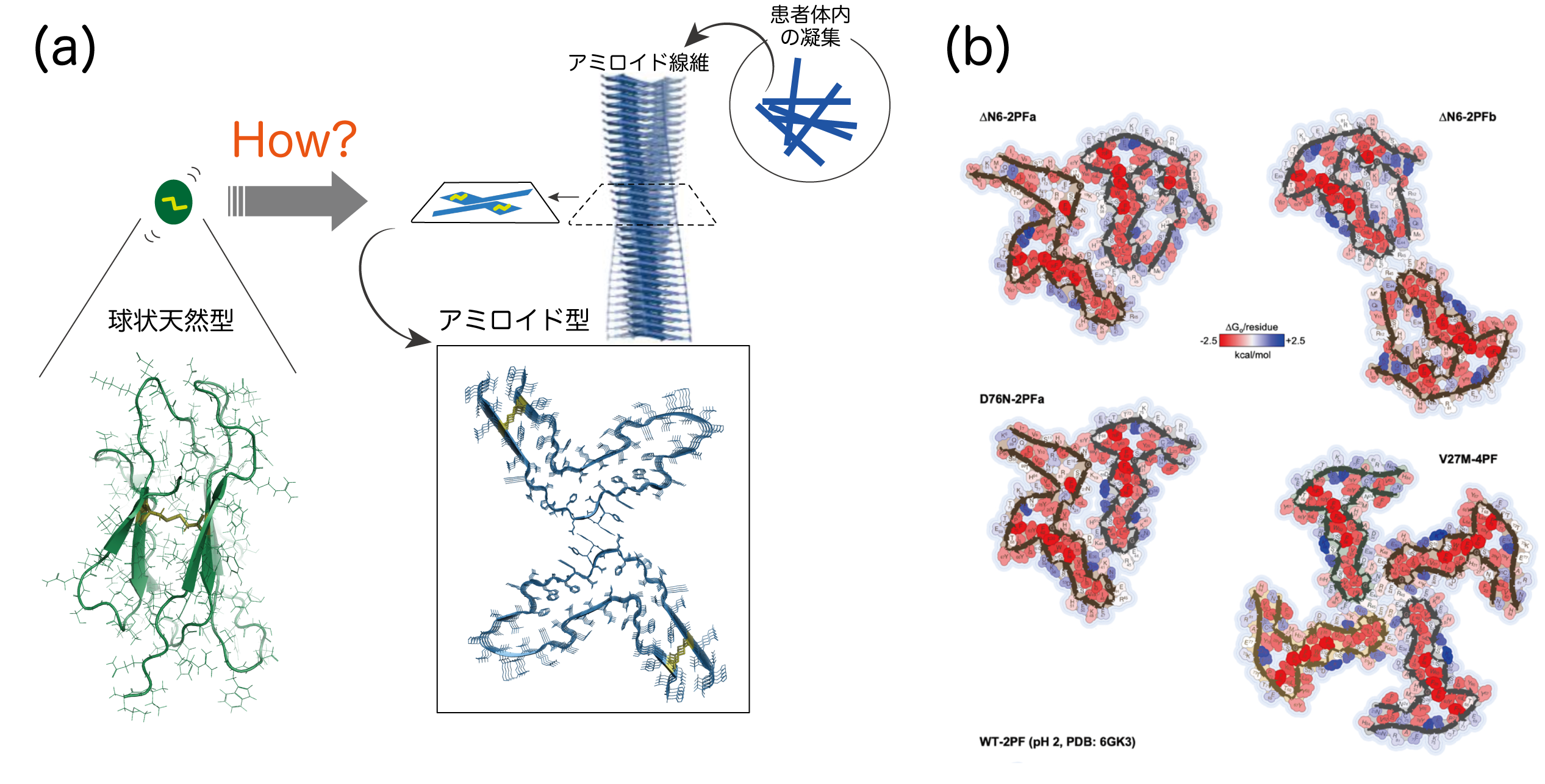
一方、蛋白質凝集・線維の機能・構造研究は極端に遅れています。それもあって多型が生まれる分子機構、多型が細胞内で何をしているか、など多くが未だに謎につつまれています。いわゆるアンフィンゼンのドグマに従う「ふつうの」蛋白質と違い、多型は遺伝子(アミノ酸配列)にコードされておらず、当然AlphaFoldなど機械学習的な立体構造予測はできません。多型は周辺環境に依存して決まると考えられ、生体環境ごとにどの多型ができるのかを、これから実験的に決めていくことが大変重要な課題です。さらに言えば、歴史的に行われてきた「純粋な希薄溶液」や「単分散状態」の蛋白質構造解析から離れ、例えばヒトの神経細胞内で直接、分子構造を決める技術の開発も中心的な重要性を持っています。われわれは固体NMRを発展させてこれを実現し、その分子機構に迫る基盤情報をえて、解明の糸口をつかもうと努力しています。これは固体NMRにしかできない挑戦といえるでしょう。
膜タンパク質
細胞膜内で外界とのインターフェイスとして信号や物質の移動に関与する膜蛋白質も固体NMRがなくてはならない解析対象です。受容体や酵素など機能性蛋白質は、その正確で効率的な動作から分子機械と例えられ、その構造と作動機構の関係は歴史的によく調べられてきましたが、1H濃度勾配で風車のごとく駆動されて回る酵素や、光励起でスイッチが入って口を開くチャネルなど、原因と結果の間に機械的で一義的な動作が定義できるものに主に焦点があたってきました。これに対し、例えばG蛋白質共役受容体(GPCR)とその共役蛋白質は、さまざまな基質分子の結合に応答して、一つの分子が多様な細胞内シグナルを出します。シグナルを中間的な強弱をつけて伝達したり(エフィカシー)、異なる信号伝達経路に重みを付けて活性化したりする (バイアス)、しなやかで多義的な信号変換器です。これをどうやって実現しているのか、詳細がまだよくわかりません。最近になって、常にゆらゆらと揺れる動的構造平衡を基質ごとに傾け、その後の情報伝達の方向性や重みを連続的に変えているらしいことが、東大・嶋田らの溶液NMRによるパイオニア的な仕事によって明らかになってきました8。野球の打者がバットをゆらゆらしながら様々な球種に応えやすいようにしているのに似ています。
もう一歩理解を前進させるために、ぜひとも「ゆらゆら運動」が含んでいる構造アンサンブルの実体に迫りたいものです。われわれはDNPをつかう極低温固体NMR技術で、この「ゆらぎ = 構造アンサンブル」を瞬間凍結し、その構造分布を定量的に観測できる手法を開発中です(図2)。GPCRと、G蛋白質などエフェクタ蛋白質のゆらぎがアロステリックに相関している可能性もあり、これは実際に構造アンサンブルを観測し、それらを相関付ける測定をしないと結論できません。また、構造ゆらぎは脂質二重膜膜環境や、膜近傍の細胞質環境が鋭敏に影響すると思われ、生細胞膜中での直接構造解析にも挑戦します。
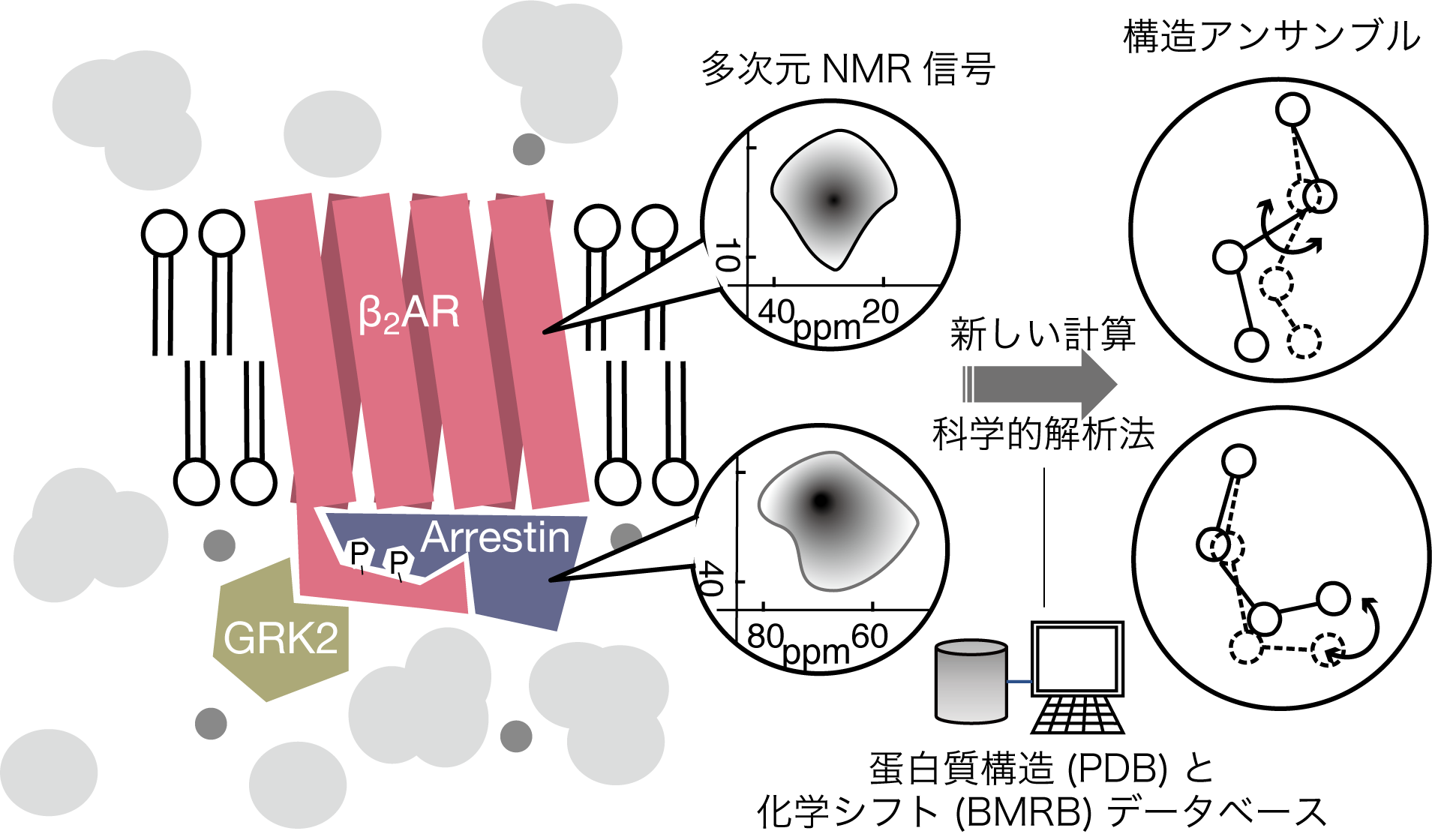
このような生命特有の柔らかで多義的な所作は、GPCRのみならず多剤排出転写因子QacR7や、アミロイド線維の線維核外部位などでも見られ2、蛋白質の普遍的な作動原理の一つだと示唆されます。従来の構造生物学ではその構造アンサンブルの基盤が全くの未解明で、ここに突破口を開くと次世代の構造生命科学に大きなステップとなるでしょう。構造中間体をたくさん含むゆらぎ構造の情報は、これまた機械学習的な構造予測の射程外で、実験的な構造情報の蓄積が今後10年の重要な課題となります。やはり固体NMRにしかできない挑戦です。
技術開発
固体NMRの装置や方法論は急速に発展しているものの、未だに技術的課題も多いです。例えばブラウン運動の不在によって残る強いスピン間相互作用が個々のNMR信号を太く弱くすることによる信号の縮退(重なり合い)と低感度があります。しかしそこがいいのです。西部開拓民のように手探りで自ら切り拓いたフィールドからは、得るものも多いです。わたしたちは特にスピン超偏極という技術でこれを抜本的に解決しようと試みています。このような挑戦的な計画では、自らの手で必要な装置から実験スキーム、解析法までを一から構築する必要があります。これは骨が折れますがたいへん面白いです。研究室のモットー「サイエンスを楽しむのに、苦労を惜しむな」の核心部分でもあります。
参考文献
- Sborgi, L. et al. Structure and assembly of the mouse ASC inflammasome by combined NMR spectroscopy and cryo-electron microscopy. Proc Natl Acad Sci U S A 112, 13237–13242 (2015).
- Hervas, R. et al. Cryo-EM structure of a neuronal functional amyloid implicated in memory persistence in Drosophila. Science (1979) 367, (2020).
- Harrison, P. M. & Gerstein, M. A method to assess compositional bias in biological sequences and its application to prion-like glutamine/asparagine-rich domains in eukaryotic proteomes. Genome Biol 4, (2003).
- Batlle, C., Iglesias, V., Navarro, S. & Ventura, S. Prion-like proteins and their computational identification in proteomes. Expert Review of Proteomics vol. 14 Preprint at https://doi.org/10.1080/14789450.2017.1304214 (2017).
- Richard, M. et al. A Quantitative Model of Sporadic Axonal Degeneration in the Drosophila Visual System. Journal of Neuroscience 42, (2022).
- Nitta, Y. et al. Direct evaluation of neuroaxonal degeneration with the causative genes of neurodegenerative diseases in Drosophila using the automated axon quantification system, MeDUsA. Hum Mol Genet 32, (2023).
- Takeuchi, K., Imai, M. & Shimada, I. Conformational equilibrium defines the variable induction of the multidrug-binding transcriptional repressor QacR. Proc Natl Acad Sci U S A 116, 19963–19972 (2019).
- Shimada, I., Ueda T., Kofuku Y., Eddy M. T., Wuthrich K, GPCR drug discovery: integrating solution NMR data with crystal and cryo-EM structures. Nature Reviews Drug Discovery 18, 59–82 (2019).