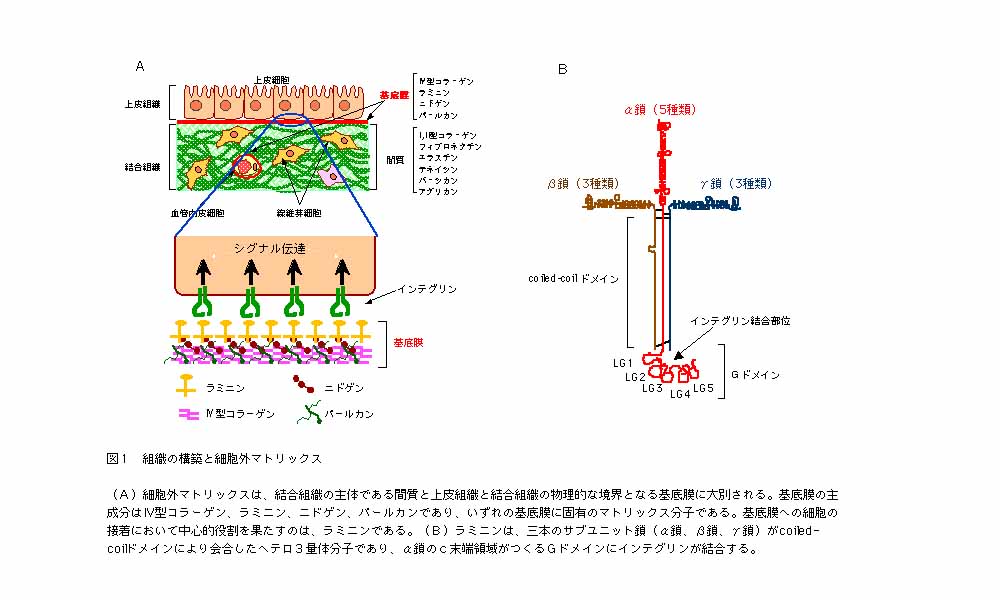
基底膜固有の構成分子として最初に同定されたラミニンは、α、β、γの3種類のサブユニット鎖がcoiled-coilドメインを介して十字架様に会合したヘテロ3量体蛋白質である(図1)。十字架の長腕が3本のサブユニット鎖がcoiled-coilドメインで会合した部分に対応し、その末端にある球状ドメイン(Gドメイン)はα鎖のC末端領域で構成されている。このGドメインは、LG(laminin
G)と呼ばれる繰り返し構造5個からできており、N末端側から3番目のLG3にインテグリン結合活性があると考えられている3)。一方、十字架の3本の短腕は各サブユニット鎖のN末端領域に対応し、これら短腕の末端部がトライアングル状の2次元格子をつくるように会合することにより、基底膜の基本骨格が形成される。
|
|
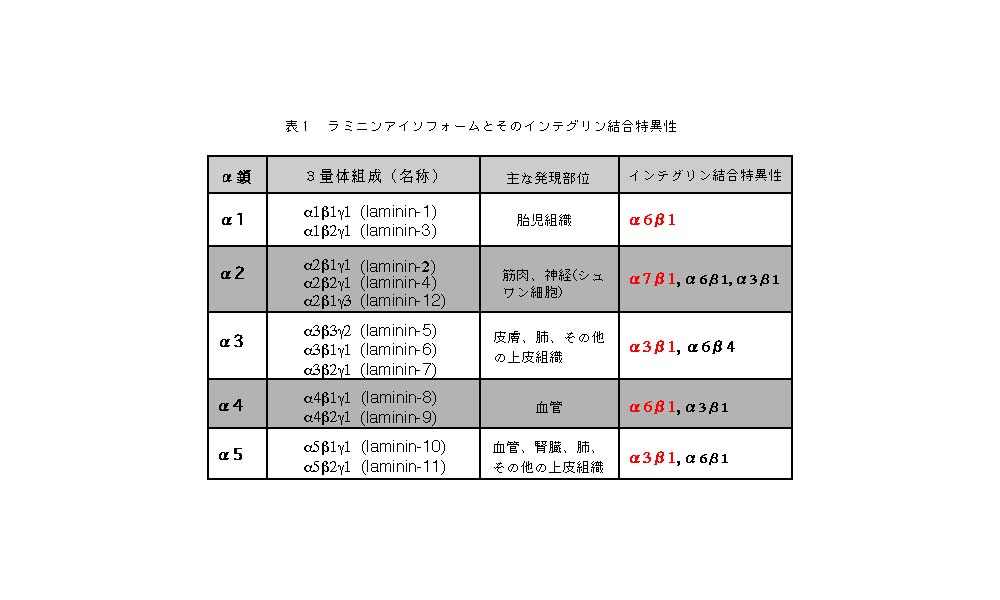
このラミニンを構成する3本のサブユニット鎖に各々複数のタイプがあることが既に明らかにされている。α鎖には5種類、β鎖とγ鎖には3種類ずつの異なるタイプがあり、それらの組み合わせの異なる12種類のラミニンアイソフォームがこれまでに同定されている(表1)。EHS肉腫から精製されたラミニンは、α1β1γ1という組成をもち、現在ではラミニン-1と呼ばれている。このラミニンー1は、ラミニンの標準品として広く世界中で使われてきたが、意外なことに、胎児の基底膜にはよく発現しているものの、成体組織の基底膜には一部の例外を除いてほとんど発現していない。いわば胎児期限定のラミニンアイソフォームと考えられる。
|
|
一方、α2〜α5鎖は成体の基底膜に発現しているが、組織特異的な発現を示す。α2鎖は筋細胞やシュワン細胞の基底膜に強く発現しているが、他の基底膜にはほとんど発現していない。α4鎖は血管基底膜に選択的に発現している。α3鎖は皮膚の基底膜に強い発現が認められる。α5鎖は成体組織に最も広範に発現しているα鎖で、血管基底膜を始めとして、様々な器官の基底膜に発現が認められる4)。ラミニンだけを考えても、基底膜は器官や細胞ごとに多様な分子組成をもっているのである。
基底膜による細胞の機能制御の機構を解き明かすには、各ラミニンアイソフォームとの相互作用によって、どのようなシグナルが細胞内に伝達され、そのシグナルが他のマトリックス分子とどのように異なっているかを知る必要がある。しかし、EHS肉腫からグラム単位で調製できるラミニン-1を除くと、α2鎖〜α5鎖を含むラミニンをミリグラム単位で精製することすら容易ではない。筆者らは、基底膜の機能解明には成人基底膜に発現する主なラミニンアイソフォーム、特にα5鎖やα4鎖を含むラミニンを精製し、その生理活性をインテグリンを介するシグナル伝達の観点から解明する必要があると考え、1996年以来、各ラミニンアイソフォームの精製を進めてきた。我々の基本戦略は、生体組織からの可溶化が困難であることを踏まえ、培養細胞の培養上清を出発材料とすること、そして各α鎖に特異的な単クローン抗体を作成して、抗体カラムでラミニンの精製を行うことの2点である。
|
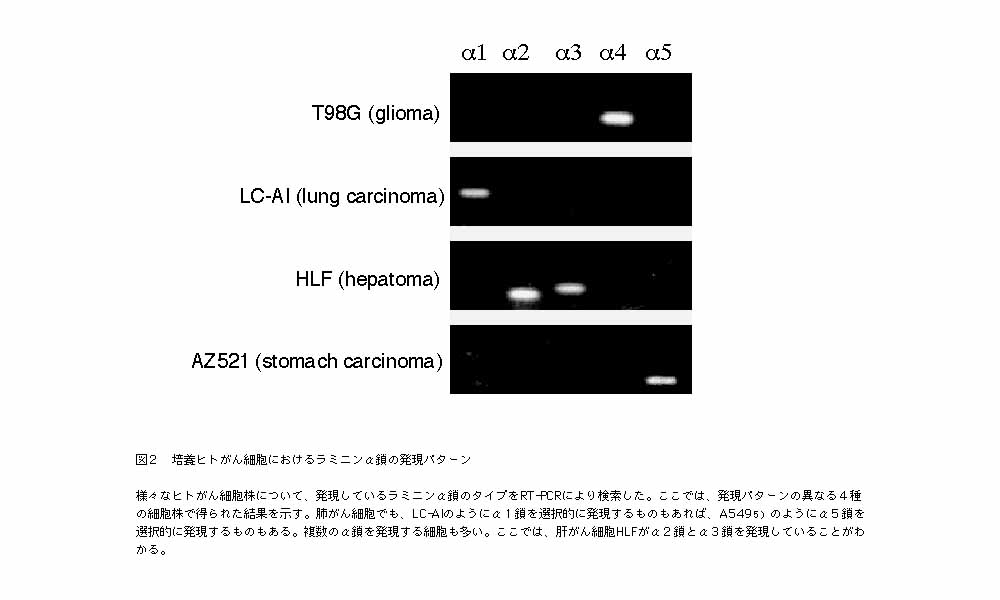
我々は、30種以上のヒト培養細胞について、ラミニンα鎖の発現をRT-PCRによりスクリーニングし、各細胞がそれぞれ特徴のあるα鎖発現パターンを示すことを見出した(図2)。たとえば、グリオーマ細胞株T98Gはα4鎖を選択的に発現しており、この細胞の培養上清からα4鎖を含むラミニンを精製することができる。培養上清からラミニンを精製するには、抗体カラムを用いる。分子量600,000〜800,000もあるラミニンをイオン交換カラムやゲル濾過だけで均一に精製するのは困難である。我々は約5年をかけて、ヒトラミニンの各α鎖と主なβ鎖、γ鎖に対する単クローン抗体をすべて作成し、これらの抗体を不溶化したカラムを用いて、α1鎖からα5鎖までのすべてのラミニンアイソフォームを精製することに最近成功している5,6)。
|
|