プロテインシーケンサーのサンプル調製法
大阪大学蛋白質研究所・生体分子解析研究室
2023.9.29 更新
PVDF膜サンプル
- SDS-PAGEの後、PVDF膜に転写して染色し(->染色プロトコール)、バンドをメスなどでできるだけ余白がないように切り出してください。
脱色は不要ですが、塩などは水と50%メタノールで十分洗い流し、1.5mlのサンプルチューブに入れてください。乾燥してかまいません。
- 実験例
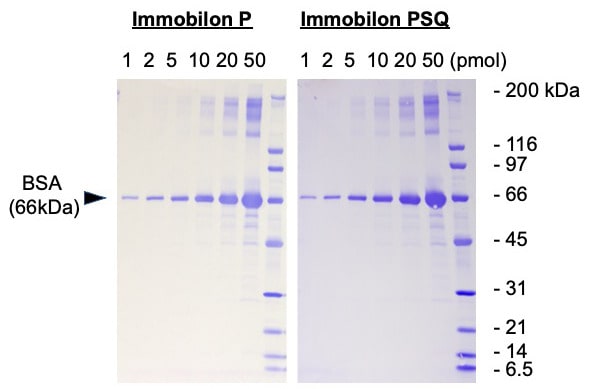
- PVDF膜はいろいろなメーカーから市販されていて、おそらく結果に大差はないと思いますが、膜によって多少性質の違いがあります。例えば、Millipore社の Immobilon Pと、Immobilon PSQは、どちらもシーケンスに使えますが、後者は前者よりポアサイズが小さいため、吸着力がより強くなっています。したがって、低分子タンパク質(< 20k)を転写する場合など、タンパク質がメンブレンを通り抜けやすい場合は、後者の方がより高い回収率が期待できます(上の実験例参照)。一方、後者は色素のバックグラウンドが抜けにくいので、染色液、脱色液の組成にやや注意が必要です。詳しくはプロトコールをご覧ください。
-
代表的な転写バッファー三種類を下に示します。基本的にはどのバッファーでもシーケンス可能です。
- Tris-Glycinバッファー(25 mM トリス、192 mM グリシン、20% メタノール)
Towbinらがタンパク質を電気的に膜に転写する方法を開発したときのものです(PNAS,76, 4350-4354, 1979年)。この論文ではタンク式でニトロセルロース膜に転写していますが、セミドライ式でも、PVDF膜でも、使うことができます。高濃度のトリスとグリシンを含むので、1サイクル目にグリシンのピークが出た場合、バッファーからの持ち込みが疑われる場合がありますので、転写後にPVDF膜を十分洗浄してください。
- 3層のバッファー(陽極バッファーI: 0.3 M Tris, pH 10.4, 陽極バッファーII: 25 mM Tris, pH 10.4
陰極バッファー: 25 mM Tris/40 mM e-aminocaproic acid, pH 9.4)
J. Kyhse-Andersenがセミドライ法を開発したときの方法です(Journal of Biochemical and Biophysical Methods 10, 203-209, 1984年)。isotachophoresisの原理に基づいて考案されたとのことです。N末シーケンスとコンパチブルですが、アミノカプロン酸にはアミノ基があるので、膜はよく洗ってください。
- CAPS バッファー (10 mM CAPS-NaOH, pH 11、 10% メタノール)
P. Matsudairaらが、N末シーケンスにSDS-PAGEのゲルからPVDF膜に転写したタンパク質を用いる方法を開発したときの方法です (JBC 262, 10035-10038, 1987年)。その論文ではタンク式で使っていますが、セミドライ式でも問題なく使えます。アミノ基を持つ成分を含まない点で、シーケンスに向いています。また、高分子が比較的よく転写されるので、ウエスタンブロットなどでも有用な場合があります。
-
高分子のタンパク質は比較的転写効率が悪い傾向があります。CAPSバッファーを使ってもセミドライ式では転写がうまくいかない場合は、タンク式で条件検討をするといいかもしれません。
溶液サンプル
- シーケンサーにアプライするサンプルは、脱塩しておく必要があります。脱塩の方法はサンプルの性質とバッファー成分の種類に応じて選択してください。
- 下記は脱塩法の一例で、PVDF膜にドットブロットしてから洗浄する方法です。この場合、PVDF膜をそのままシーケンサーのバイヤルに入れるので、シーケンスに十分な量のタンパク質が1枚(~数枚)の膜に乗っているようにしてください。サンプルのロスはおそらくほとんどないと思いますが、界面活性剤などが多量に入っていると、界面活性剤が膜にくっついてタンパク質が結合しにくいといったことも考えられるので、そのような場合はSDS-PAGEをしてから転写した方が無難かもしれません。
方法
- PVDF膜をメスで約 2 x 5 mm の長方形に切る。(注)
- メタノール約 1 μl を膜にのせる。
- メタノールが乾燥しないうちに、サンプルをのせる(< 約 2 μl)。
- 乾燥するまで待つ。
- サンプルチューブに入れる
- 50%メタノールで何度か洗う。
- 10%メタノールで何度か洗う。
- 80%メタノールで何度か洗う
- 乾燥してサンプルチューブで保管する。
注:膜の大きさは、シーケンサーのバイヤル(φ mm、 円形)に入る大きさであればよく、直径 6 mm 程度の丸型でもかまいません。メタノールやサンプルの容量は膜の面積にしたがって変更してください。
- 脱塩した溶液のまま送付される場合、いちどにシーケンサーにアプライできるサンプル量は10 μl程度ですので、できるだけシーケンスに必要なタンパク質が10 μlの水に溶けているように調整してください。
HPLC分取サンプル
- 水/アセトニトリル/TFA系を用いた逆相HPLCを推奨します。
- リン酸塩類、酢酸塩類などの塩類を含んだバッファーは使用しないでください。どうしてもサンプルに塩が入ってくる場合は、C18のカートリッジカラムや逆相HPLCなどで脱塩してください。
- HPLCグレード以上の高純度試薬を用いてください。
