2) 多様なアミノ酸残基側鎖を対象とした蛋白質の構造動態解析法の開発
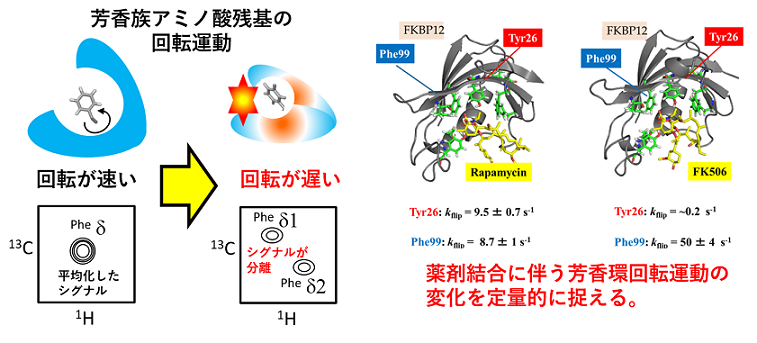
従来のNMR法では、蛋白質主鎖のアミド基や側鎖メチル基を対象とした運動性解析や相互作用解析が大半を占めている。一方で、蛋白質間の相互作用や蛋白質と薬剤との相互作用においては、芳香族アミノ酸の芳香環や側鎖水酸基など、さまざまな官能基が関連しており、かつ、相互作用に伴ったそれらの運動性変化が、機能発現を高次に制御していることが考えられている。
我々は、SAILアミノ酸の改良を重ね、従来法では高精度に捉えることができなかった、芳香環の回転運動や水酸基交換運動、カチオン―π相互作用などを対象に、それらを定量的に解析する手法の開発を進めている。具体的にはFKBPと免疫抑制剤との相互作用、抗体ー抗原反応、蛋白質分解反応および天然変性蛋白質による液―液相分離や線維構造形成機構を題材に研究を進めている。
Development of new structural dynamics analysis method using SAIL-NMR
The SAIL-NMR method has the potential to create innovative methods not only in protein three-dimensional structure analysis but also in interaction analysis and dynamics analysis. Nowadays, it is generally accepted that folded proteins occasionally undergo large-amplitude slow-breathing motions (LASBMs), suggesting that they are closely related to their biological function. We have been developing new method for quantitatively analyze for LASBMs of various proteins using new SAIL amino acids.
関連論文:
Yang et al., Biochemistry (2015)
[https://pubs.acs.org/doi/10.1021/acs.biochem.5b00820]
Takeda, Miyanoiri et al., MR (2022)
[https://doi.org/10.5194/mr-2-223-2021]