研究解説
Recent achievemnts
・NAC法による新しいライゲーション法 [Tetrahedron Lett., 56, 1370 (2015)]
タンパク質の合成は、ペプチドチオエステルを固相合成し、別のペプチドセグメントと縮合することによってなされます。私たちは、N-Alkylcysteine(NAC)を用いた効率的なチオエステル合成法を開発しました。Fmoc法により効率的にチオエステルを得ることのできる優れた方法です。しかし、これまでNAC法による固相合チオエステル合成においては、固相成後にチオエステル化、精製の段階が必要でした。チオエステル化には1日前後必要であるため、迅速なタンパク質合成の面から改善が必要でした。この論文では、NACのC末端をカルボン酸とすると、チオエステル化と同時に別のペプチドとの縮合が進行するため、別途チオエステル化を行う必要がなくなりました。タンパク質合成の効率化に大きな進歩です。
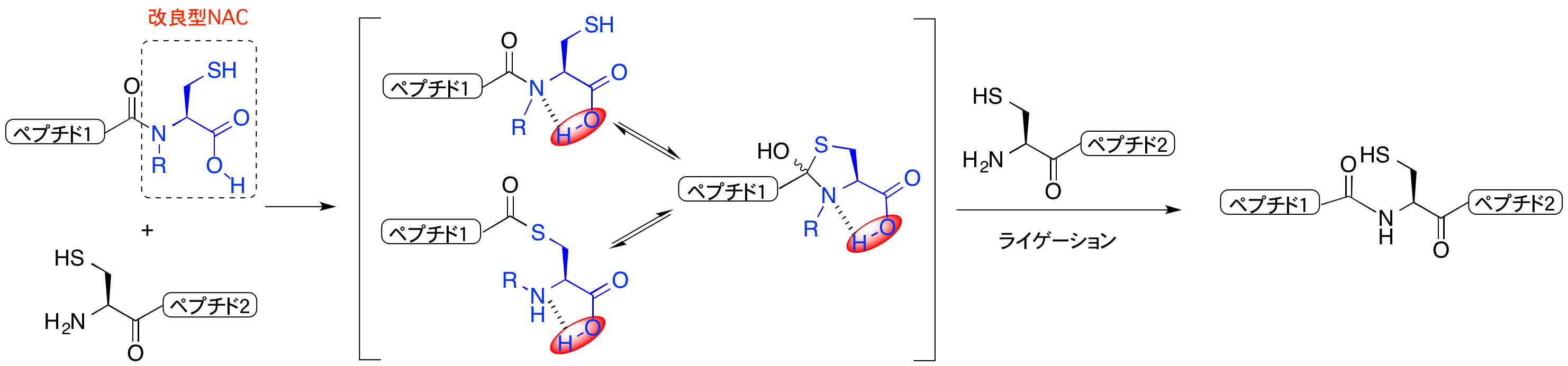
図. 新規NACを用いたライゲーション法
・糖ペプチドチオエステルの簡便な合成法 [J. Carbohydr. Chem., 34, 12 (2015)]
私たちの糖タンパク質合成においては、糖鎖を持つペプチドチオエステルを固相合成し、その後別のペプチドとの縮合を行い、長鎖のポリペプチド、タンパク質へと導きます。糖鎖部分には多くの水酸基があるため、固相合成時にはこれらの水酸基(TFA)をベンジル基により保護します。固相合成後は、トリフルオロ酢酸によりペプチド鎖部分の保護基の除去、樹脂からの脱離を行います。ところが、糖鎖のベンジル基はTFAに対して比較的安定であるため、糖ペプチドの合成にはTFA処理の後、さらにより強い酸性条件でのベンジル基の除去が必要となります。糖鎖が短い場合には問題ありませんが、糖鎖が長くなると、ベンジル基の除去の際一部の糖鎖の分解が見られるようになり、改善が必要でした。本論文では、ベンジル基よりも酸に対する安定性を下げたメチルベンジル基を糖鎖水酸基の保護基として用いると、TFAによるペプチド鎖の脱保護の際に、同時に糖鎖の保護基も除去できることがわかり、より効率的な糖ペプチドの合成が可能となりました。
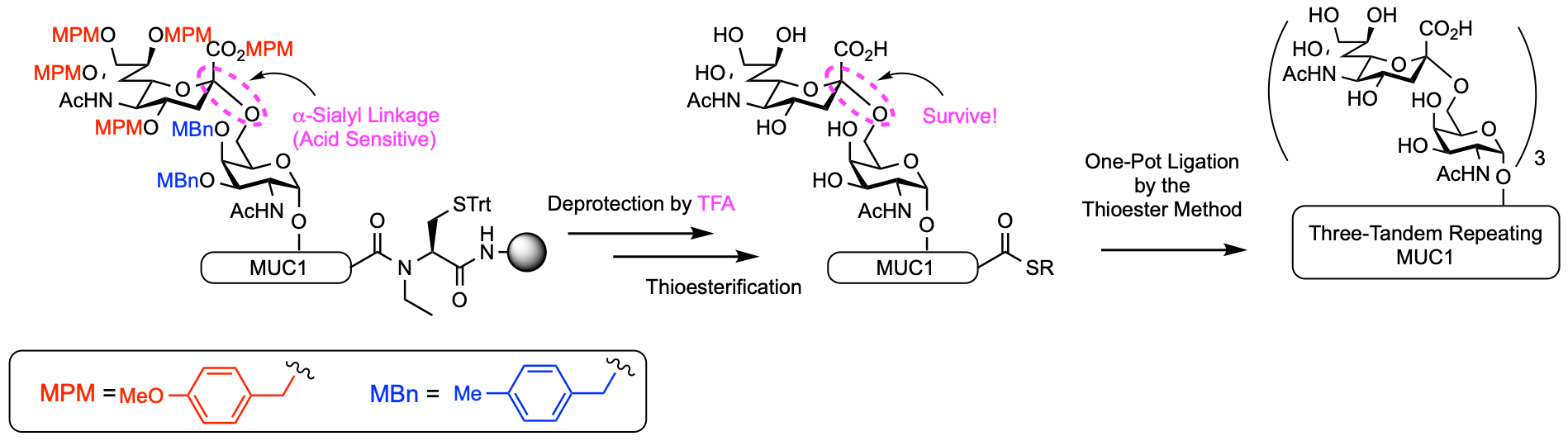
図. MBn基を用いた効率的な糖ペプチド合成法
・繊維芽細胞増殖因子受容体膜貫通-膜近傍部位の構造解析 [Biochemistry, 53, 5000-5007 (2014)]
FGFR(繊維芽細胞増殖因子受容体)は骨形成に関与します。ヒトには4種類のFGFRが存在しますが、現在、我々はFGFR3に注目して、その構造と機能の相関を明らかにすべく研究を進めています。FGFR3の膜貫通部位にはG380Rという小人症の原因ともなる変異が見出されています。この変異によってFGFR3は活性型となってしまい、細胞外部からの刺激がなくても、骨の形成を妨げる信号を流し続けます。我々はFGFR3の膜貫通ー細胞質内膜近傍部位に関して、この活性型の変異を含んだ配列と野生型(あるべき配列)の配列の脂質二重膜中における構造比較解析を行いました。合成化学的に特異的な標識を導入したFGFR3膜貫通ー膜近傍部位に関して、固体NMRやIR、蛍光測定を行ったところ以下の物性が明らかとなりました。1)野生型では細胞質内膜近傍部位は酸性脂質二重膜に結合しているが、G380R活性型変異を含んだ配列では当該部位は膜から解離する;2)G380R変異を含んだ膜貫通部位は野生型と比べて、脂質二重膜に対して、より垂直に近い形で存在する;3)野生型の配列に関しても、より厚い脂質二重膜に包埋すること(脂質二重膜に対して「立たせる」)によって細胞質内膜近傍部位は膜から解離すること。これは、FGFR3の活性化機構、細胞質内領域における機能発現において、この膜近傍部位の膜からの解離がカギとなる構造変化になりうることを示していると考えています。また、FGFR3の活性化においては、膜貫通部位の脂質二重膜に対する配向の変化が関与することも示唆されたと考えています。
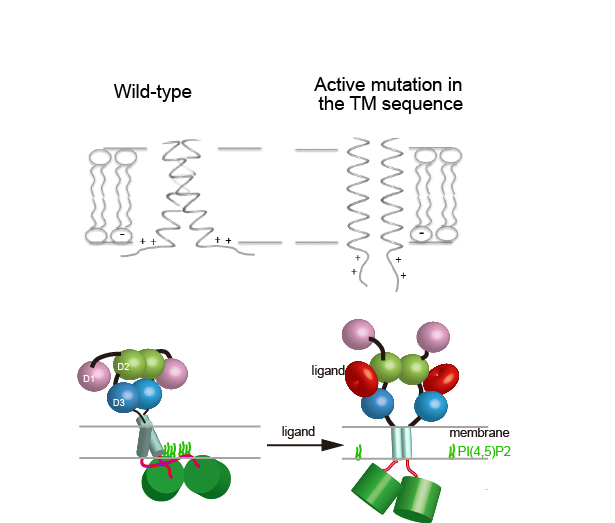
図. 我々が見出した膜貫通-膜近傍部位の脂質二重膜中における物性(上段)とそれに基づいた活性化機構のモデル。Tamagaki et al.Biochemistry 2014
