・TFA感受性保護基を利用した糖ペプチド合成と、ワンポット4セグメントライゲーションを利用したヒストンH2Aの化学合成 [Y. Asahina et al., Eur. J. Org. Chem, 1915-1920 (2019) VIP Paper!]. DOI:10.1002/ejoc.201801885
ヒストンは、細胞核内にあるDNA鎖の収納を担うだけでなく、遺伝子発現の制御も行う重要なタンパク質です。これら機能は、ヒストンの翻訳後修飾の状態によってコントロールされていることが知られており、多くの研究者がこの制御機構の解明を行おうとしています。近年、ヒストンH2Aの水酸基のN-アセチルグルコサミン(GlcNAc)修飾が、遺伝子修復に寄与していると報告され、より詳細な機能解析が求められていました。しかし、微量かつ不安定な糖鎖付加したヒストンを天然から取り出すのは至難の技であり、純粋な糖ヒストンサンプルの調製法が望まれていました。そこで、我々は、均一なGlcNAcを持つヒストンH2Aの合成を行うことにしました。合成の際には、2つの手法を用いて効率よく合成することにしました。それは、(1)TFA感受性保護基を利用した糖ペプチド合成と、(2)チオエステルと2種類のチオエステル等価体を利用したワンポット4セグメントライゲーション法によるポリペプチド合成です。(1)では、近年我々が見出した4-メチルベンジル基を糖水酸基保護基に利用することで、最終脱保護工程が高効率化され、特殊な操作を行うこと無く、普通のペプチドと同じ様に糖ペプチドを合成できるようになりました。その結果、目的の糖ペプチドを大量かつ簡便に取得することができました。(2)では、ペプチドチオエステルと、我々が開発したペプチドチオエステル等価体、システイニルプロリルエステル(CPE)とN-アルキルシステイン(NAC)を組み合わせて利用することで、4つのペプチドセグメントに分けられた目的ポリペプチドをワンポットで連結することができました。その結果、2回の精製工程を省略することで、短時間かつ大量かつ簡単にH2Aの全長鎖を得ることができるようになりました。この合成で得られた純粋な糖ヒストンは、今後、ヌクレオソーム形成の検討や、立体構造解析等に用いていく予定です。
この論文はEuropean Journal of Organic Chemistry誌のVIP Paper (Very Important Papaer)に選ばれました!
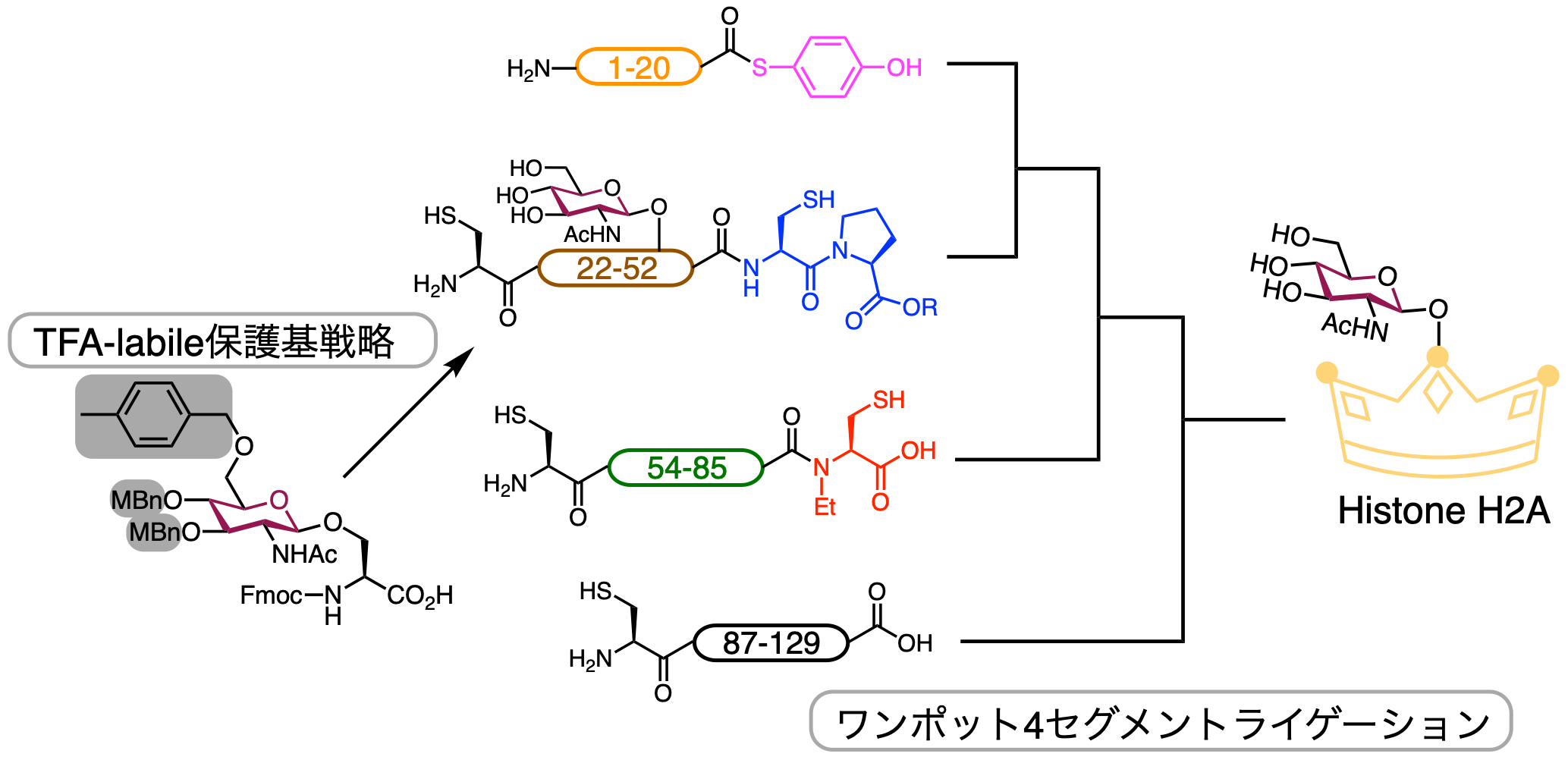
ヒストンH2Aの化学合成.
・TFA中でもシアル酸が切れない!?酸感受性保護基を利用したシアリル糖ペプチドの合成 [N. Takeda et al., Chem. Eur. J. 24, 2593-2597 (2018) Hot Paper!]. DOI:10.1002/chem.201706127
糖脂質や糖タンパク質糖鎖の非還元末端には、シアル酸という糖が、よく付加し、色々な生命現象に関わっています。このシアル酸は、1位にカルボン酸を持つ9炭糖で、他の一般的な糖と違ってユニークな化学的性質を持ちます。それは、酸に対して極めて不安定で、簡単にシアル酸のグリコシド結合が分解してしまうことです。ペプチド合成後の脱保護では、必ず何らかの酸処理を行わなければならず、この酸処理中では、たちまちシアル酸の結合が分解してしまうだろうと、常識的に予測されていました。こういった観点から、シアル酸を含むペプチドの合成は、非常に難しいと考えられていました。しかし、本研究では、我々が展開している酸感受性保護戦略を利用すると、従来のペプチド合成法と何ら変わらない方法で合成できるようになりました。また、2つの保護基を組み合わせることで、予想されていたシアル酸のグリコシド結合の分解も、ほぼ生じないということも分かり、今までの常識を覆す結果となりました。得られた糖ペプチドを、チオエステル法により、他のペプチドセグメントと連結することで、MUC1のタンデムリピートドメインの合成に成功することができました。今回は、もっとも単純なシアリルTn抗原糖鎖の2糖の合成に利用しましたが、今後は、より複雑なシアル酸含有オリゴ糖の合成に応用していきたいと考えています。 (この論文はChemistry A European JournalのHot Paperに選ばれました!)
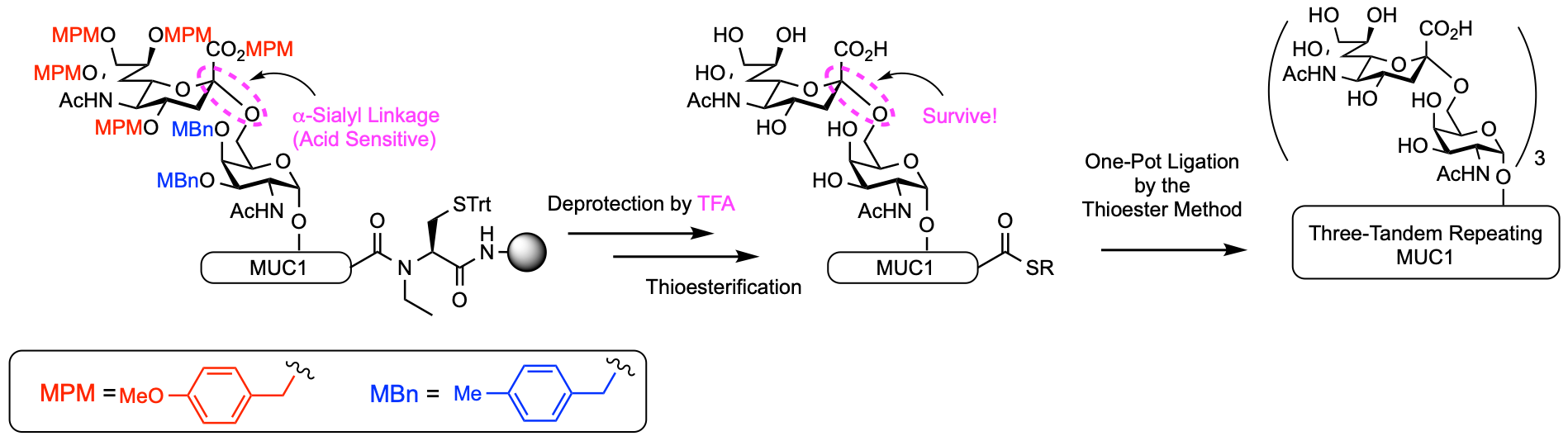
酸感受性保護基を利用したシアル酸含有糖タンパク質の合成.
・One-pot 4 segment ligation法によるヒトsuperoxide dismutaseの合成 [T. Takei et al., Angew. Chem. Int. Ed., 56, 15708–15711 (2017). DOI:10.1002/anie.201709418
タンパク質の化学合成は、ペプチドチオエステルと別のペプチドセグメントを化学選択的に縮合することによって達成されます。一般的に、タンパク質の精製過程における回収率の低下は大きな問題ですが、私たちは既にこの問題の解決策として、芳香族チオエステルとアルキルチオエステルの反応性の差を利用し、3つのペプチドセグメントを精製することなく連続的に縮合する手法を開発しています。しかし、より大きなタンパク質を効率的に合成するためには、それ以上の数のペプチドセグメントを連続的に縮合することの出来る手法の開発が望まれていました。そこで本研究では、硫黄の同族元素であるセレンを含むセレノエステルに着目し、4つのペプチドセグメントを連続的に縮合する手法を開発しました。芳香族セレノエステルは、芳香族チオエステルと比較して非常に高い反応性を持ち、活性化剤を添加することなく、塩基性条件下で速やかにペプチド結合を形成します。そこで、私たちが既に開発していた縮合法と組み合わせたところ、153残基のアミノ酸からなる酵素、スーパーオキシドディスムターゼ (SOD) の全長配列を一度も精製することなく合成することに成功しました。また、一般的にセレノエステルはいくつかの合成過程を経ないと得ることはできませんが、私たちの開発したN-alkylcysteine (NAC) 法を適用した簡便な合成法も確立されました。本研究によって開発された縮合法及びセレノエステルの合成手法は、様々なタンパク質の合成に応用できるため、タンパク質の合成研究の発展に寄与することができると考えています。
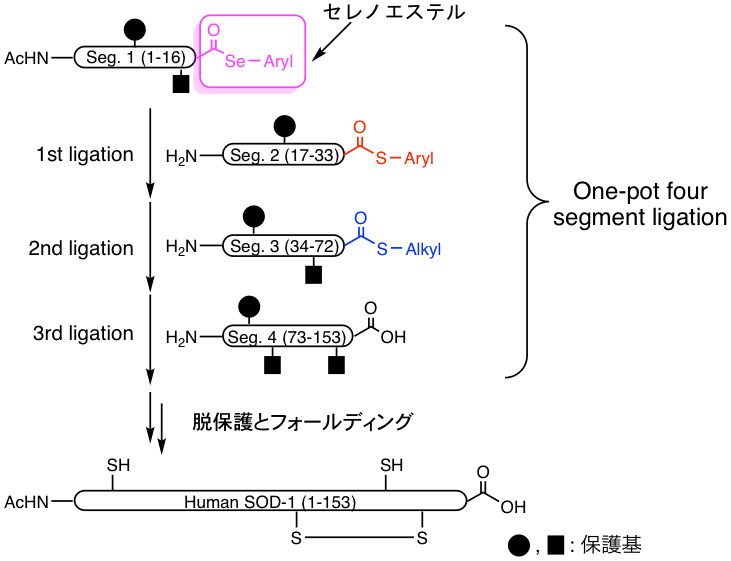
芳香族セレノエステルを用いた4つのペプチドセグメントの連続的縮合法.
・2種類のチオエステル化前駆体を利用したワンポットNCL法 [Chem. Chommun., 53, 2114 (2017). DOI:10.1039/c6cc10243c
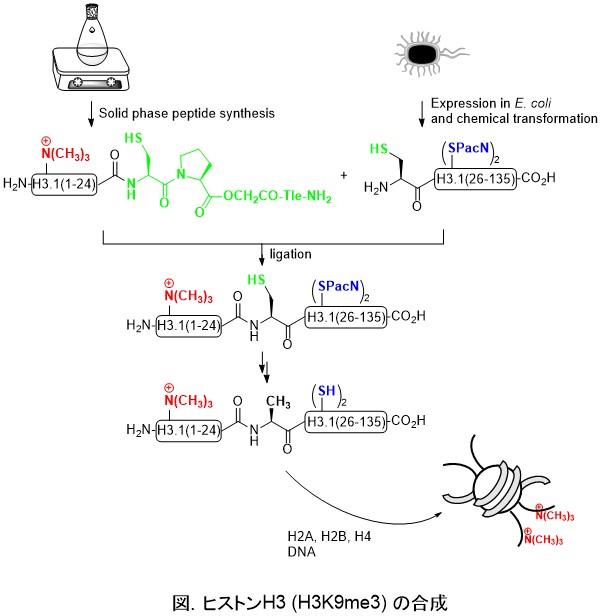
長鎖のポリペプチドを合成するためには、ペプチドセグメント同士を縮合するライゲーションが利用されることになります。いくつかあるライゲーション法の中でも、特にネイティブケミカルライゲーション(NCL)法は、様々なポリペプチド合成に用いられてきました。しかし、今までのNCL法では、3つのペプチドセグメントを1つのポリペプチドへ縮合していく際に、中間体の精製を行わなければなりませんでした。タンパク質合成において、精製工程は、とてもやっかいな工程であり、特にペプチドの溶解性が悪い場合、回収率の大幅な低下が見込まれてしまいます。 そこでこの問題を、本研究では、当研究室で開発されたチオエステル前駆体であるシステイニルプロリルエステル(CPE)とN-アルキルシステイン(NAC)を組み合わせて利用することで、中間体の精製を回避したワンポットNCL法を開発しました(下図)。CPEとNACは、異なるpHで選択的に活性化され、NCL反応を進めることができました。その結果、効率良くヒトヒストンH4の化学合成に成功することができました。今後は、この方法によって他のタンパク質も効率良く合成できるようになると期待しています。
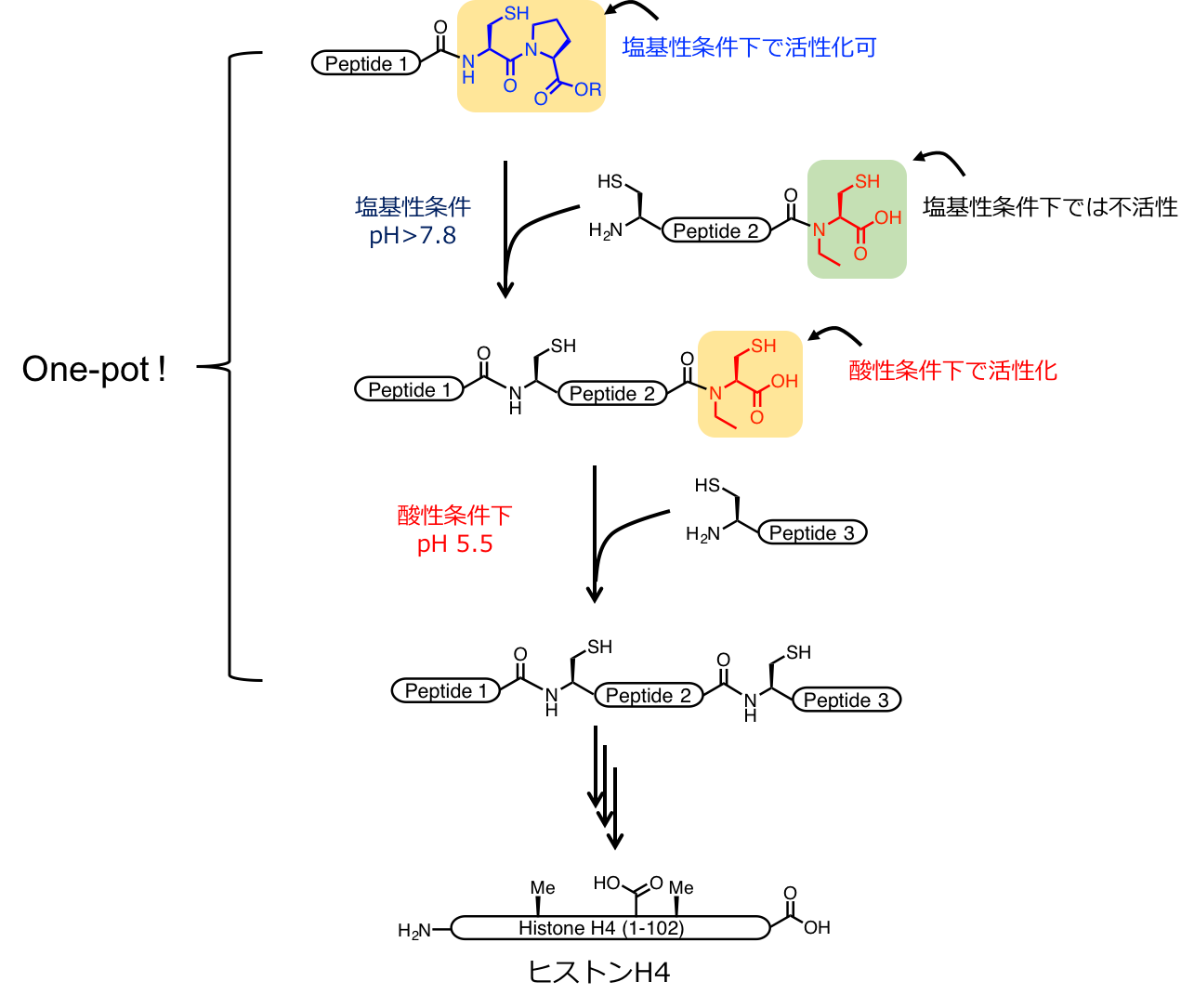
CPEとNACを組み合わせたヒストンH4の化学合成.
・修飾ヒストン蛋白質の合成 [J. Biochem., published online May 22, 2015 (doi:10.1093/jb/mvv056)]
ヒストンは真核細胞の核内でDNAを収納する足場となる100残基を超える蛋白質です。ヒストンH2A、H2B、H3、H4各2分子からなる8量体に147塩基対のDNAが巻きついてヌクレオソームが形成されます。これらのヒストンはN末側にフレキシブルなテール領域をもち、アセチル化、メチル化、リン酸化などの翻訳後修飾を受け、遺伝情報発現の制御に関与しています。多くの修飾部位がN末端側テール領域にあることから、化学合成修飾ペプチドをN末端側、組換えペプチドをC末端側合成ブロックとして、これらを縮合するライゲーション法を開発しました。
本研究では、9番目のリシンをトリメチル化したヒストンH3 (H3K9me3) と20番目のリシンをトリメチル化したヒストンH4 (H4K20me3) の合成を行いました。化学合成修飾ペプチドと組換えペプチドをライゲーションする手法は簡便であり、トリメチル化以外にも様々な修飾に対応でき、また、ヒ ストンH2AやH2Bの合成にも適用可能です。本法によってN末端側テール領域修飾ヒストンライブラリーを構築すれば、それらのヒストン修飾にかかわるエ ピジェネティクス研究の基盤となり、当分野の進展に大きく寄与できると考えています。
・IL2の化学合成 [Angew. Chem. Int. Ed. 54, 8226 (2015)]
インターロイキン2(IL-2)は、細胞性免疫に関わるサイトカインの一種です。私達の研究室では、長年にわたりこの糖タンパク質の化学合成に取り組んできました。基本的には、IL-2の全配列をいくつかの短いペプチド鎖(セグメントといいます)に分割して合成した後、それらをつなげる方法を用いてきました。しかし、IL-2は水に可溶性の糖タンパク質であるにもかかわらず、セグメントに分割するとそのC末端部分は全く水に溶けません。この問題の解決が困難であり、これまでIL-2の全合成が妨げられてきました。
今回私達は、溶解性の悪いC末端側のセグメントに存在するグルタミン酸の側鎖カルボン酸を、ピコリルエステルとして保護し、酸性から塩基性に極性反転する方法を検討しました(下図)。その結果、精製あるいはセグメント同士を縮合する際の酸性条件下において、C末端セグメントの溶解性を飛躍的に向上させることに成功しました。このことがきっかけとなり、IL-2の全合成が達成されました。得られた化学合成IL-2は組換えDNA法により得られたIL-2と全く同じ生物活性を示し、また円二色性スペクトルでも組換えタンパク質と同じ二次構造を持つことが明らかとなりました。このことから化学合成により天然物と同じサイトカインの合成が達成されたことが示されました。
IL-2と同様にヘリックス構造を持つサイトカインは多く、これまで同様の理由で合成が阻まれていたサイトカインや、タンパク質、糖タンパク質の合成が達成され、その機能、構造解析が進展するのではないかと期待されます。
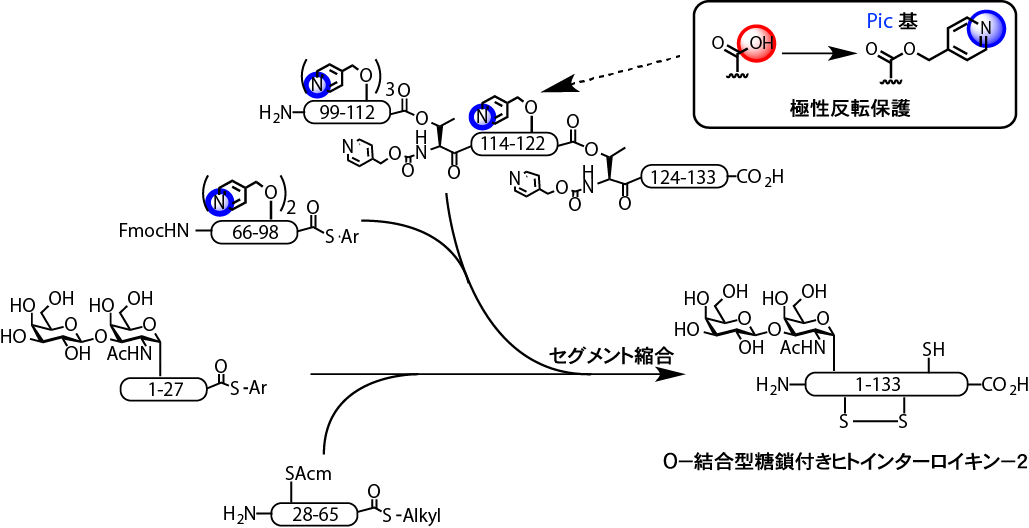
図. IL2の化学合成
