ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 報酬・嫌悪学習が細胞外スルファターゼにより制御される仕組みを解明
プレスリリース
2026.01.22
報酬・嫌悪学習が細胞外スルファターゼにより制御される仕組みを解明
報酬学習と嫌悪学習の両方において、細胞外でヘパラン硫酸(さまざまな生理機能を調節する糖鎖)の硫酸基を除去する酵素「スルファターゼ1(Sulf1)」が必要なこと、また、これらの学習に重要なドーパミン神経回路をSulf1が調節していることを、マウスを用いた行動実験により明らかにしました。
- ある行動の結果として報酬(好ましい結果)や嫌悪(好ましくない結果)が得られることを学習し、その行動を強化する報酬学習や嫌悪学習には、大脳基底核の一部である側坐核が関与しています。一方、細胞外スルファターゼ(Sulf1とSulf2)は、ヘパラン硫酸糖鎖の硫酸基を分解することによりさまざまな細胞機能を調節する酵素ですが、これらについての研究の多くは発生とがん化に関するもので、成体脳機能との関わりはよく分かっていませんでした。本研究グループはこれまでに、Sulf1遺伝子が成体マウスの脳、とりわけ側坐核や前頭皮質などに強く発現していることを見いだしており、今回、側坐核におけるSulf1遺伝子の役割を調べました。
- 本研究では、Sulf1遺伝子を破壊したノックアウトマウスを用いて行動実験を行ったところ、報酬学習も嫌悪学習も低下していることが分かりました。さらに、ドーパミンD1受容体を発現する細胞(D1細胞)とドーパミンD2受容体を発現する細胞(D2細胞)で別々にSulf1遺伝子をノックアウトしたマウスで同様の行動実験を行なったところ、D1細胞でSulf1遺伝子をノックアウトすると報酬学習が低下し、D2細胞でSulf1遺伝子をノックアウトすると嫌悪学習が低下しました。これらの結果から、Sulf1は、報酬学習と嫌悪学習の両方に必要であり、D1細胞とD2細胞の両方の神経回路の調節に関わっていることが明らかになるとともに、Sulf1が発生期のみならず成体脳の機能に関与することが示されました。
研究代表者
筑波大学医学医療系
桝 正幸 教授
大阪大学蛋白質研究所
疋田 貴俊 教授
研究の背景
細胞外スルファターゼ注1)(Sulf1とSulf2)は、ヘパラン硫酸糖鎖注2)の硫酸基を分解する酵素として知られています。ヘパラン硫酸は細胞外でさまざまな生体物質と相互作用することにより多様な生理機能を調節していますが、糖鎖内部の硫酸基がシグナル分子との相互作用に必要なため、細胞外スルファターゼが作用して硫酸基が分解されると細胞の機能が変化します。Sulf1とSulf2の役割については、発生とがん化に関する研究がほとんどで、成体の脳機能との関連はあまり調べられていません。
本研究グループはこれまでに、細胞外スルファターゼ遺伝子が成体マウスの脳でも発現し、特にSulf1は、側坐核(大脳基底核の一部)や前頭皮質などに強く発現していることを見いだしており、成体の脳機能とも密接に関係していると考えられましたが、その役割は不明でした。そこで今回、報酬・快楽と関係が深く、薬物依存症や精神疾患との関わりも示唆されている側坐核におけるSulf1遺伝子の役割を調べました。
研究内容と成果
まず、全身でSulf1遺伝子をノックアウトしたマウスで報酬・嫌悪学習を行いました。報酬学習には、条件付け場所嗜好性試験注3)を用い、報酬を受けた部屋を好むようになるかどうかを調べたところ、Sulf1ノックアウトマウスで報酬学習が低下していました。また、嫌悪学習には、抑制性回避試験注4)を用い、嫌悪刺激を受けた部屋へ入ることを避けるかどうかを調べたところ、Sulf1ノックアウトマウスで嫌悪学習が低下していました。従って、Sulf1は報酬学習と嫌悪学習の両方に必要であることが分かりました(参考図)。
側坐核は、中型有棘ニューロンと呼ばれる神経細胞から成り、その活動はドーパミンによって調節されています。中型有棘ニューロンには、ドーパミンD1受容体を発現する細胞(D1細胞)とドーパミンD2受容体を発現する細胞(D2細胞)の2種類があり、これらは異なる神経回路を形成し、異なる役割を担っていることが知られています。Sulf1遺伝子は両方の細胞で発現しており、それぞれの細胞における役割を明らかにするため、Sulf1遺伝子をD1細胞とD2細胞で別々にノックアウトしたマウスを作製し、行動実験を行いました。その結果、D1細胞でSulf1遺伝子をノックアウトすると、条件付け場所嗜好性試験において報酬を受けた部屋を好む傾向が減りましたが、抑制性回避試験は正常であったことから、報酬学習のみが低下していることが分かりました。一方、D2細胞でSulf1遺伝子をノックアウトすると、抑制性回避試験において嫌悪刺激を受けた部屋を避ける傾向が減りましたが、条件付け場所嗜好性試験は正常であったことから、嫌悪学習のみが低下することが分かりました。従って、Sulf1はD1細胞とD2細胞の両方で働き、おのおのの細胞の正常な機能の維持に関与することが明らかになりました。また本研究により、Sulf1が発生期のみならず成体の脳機能調節においても重要であることが示されました。
今後の展開
Sulf1遺伝子をノックアウトすると、ヘパラン硫酸糖鎖が過剰に硫酸化され、そこに結合するシグナル分子などが変化するため、細胞の機能に影響を及ぼします。そこで、Sulf1ノックアウトマウスにおける報酬・嫌悪学習の異常が神経細胞のどのような変化で引き起こされるのかを明らかにすることが必要です。また、報酬・嫌悪学習の障害は、さまざまな精神疾患と深く関わるため、その神経基盤を解明することは医学的にも社会的にも重要です。今後、細胞外スルファターゼの働きをさらに調べることにより、側坐核の生理機能の解明が進むとともに、精神疾患の発症のメカニズムが明らかになると考えられます。
参考図
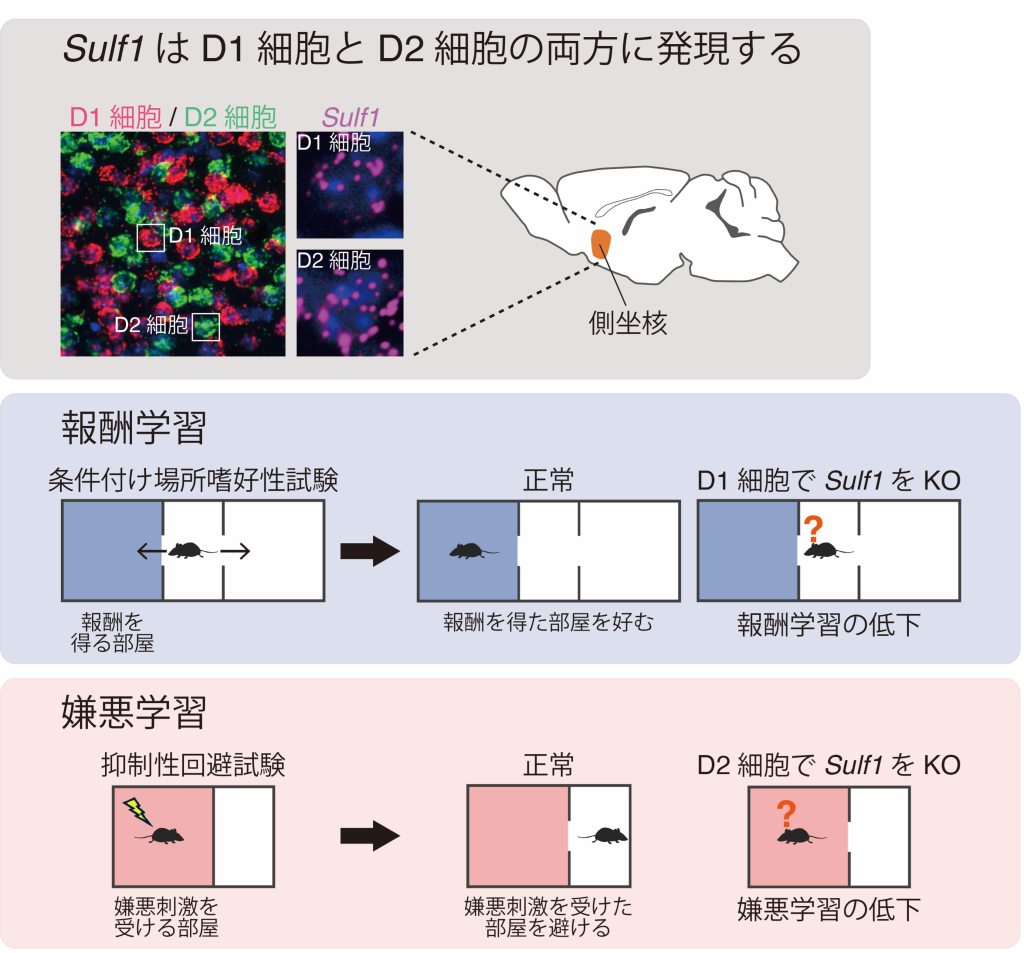
図 側坐核細胞におけるSulf1(マゼンタ色)、ドーパミンD1受容体(赤色)、ドーパミンD2受容体(緑色)の遺伝子発現を示した顕微鏡写真(上段)。Sulf1がD1細胞とD2細胞の両方に発現している。Sulf1遺伝子をD1細胞でノックアウト(KO)すると報酬学習が低下し(中段)、D2細胞でノックアウトすると嫌悪学習が低下した(下段)。
用語解説
注1)細胞外スルファターゼ
硫酸基を加水分解する酵素をスルファターゼと呼ぶ。ほとんどのスルファターゼは細胞内で働くが、細胞外で働くスルファターゼ(Sulf1とSulf2)は、ヘパラン硫酸の6位の硫酸基を分解しヘパラン硫酸とシグナル分子の相互作用を変化させることにより、さまざまな細胞機能を調節する。
注2)ヘパラン硫酸糖鎖
2種類の糖から成る構造が繰り返した糖鎖で、タンパク質と結合した糖タンパク質として存在する。体内に広く存在し、細胞外でさまざまな分子と相互作用して、多様な生理機能を発揮する。糖鎖内部に硫酸化され得る部位を多数持ち、硫酸化の違いによりシグナル分子との結合が変化する。
注3)条件付け場所嗜好性試験
2つの部屋とそれらをつなぐジョイントスペース成る実験装置を用い、快感をもたらすコカインを投与したマウスを片方の部屋に入れ、数時間後に、同じマウスに快感をもたらさない生理食塩水を投与して別の部屋に入れる。この処置を3日間繰り返すと、マウスはコカイン投与を受けた部屋を好むようになり、その部屋での滞在時間が延長する。この嗜好性の獲得から報酬学習を評価する。
注4)抑制性回避試験
明るい部屋と暗い部屋から成る実験装置を用い、マウスを明るい部屋に入れた後、暗い部屋へ移動するまでの時間を計測する。マウスは暗い場所を好むため、比較的速やかに暗い部屋へ侵入するが、暗い部屋に入った時に嫌悪刺激である電気ショックを与えると、暗い部屋へ入るのを避けるようになる。このときの暗い部屋へ入るまでの時間の延長から嫌悪学習を評価する。
研究資金
本研究は、科研費(JP20300108, JP25293065, JP21K15210, JP23K24205, JP23K18163, JP25K02547)、AMED(JP25wm0625322, JP21gm1510006)、武田科学振興財団、内藤記念科学振興財団、先進医薬研究振興財団精神薬療研究助成、および大阪大学蛋白質研究所共同研究拠点事業の支援を受けて実施されました。
掲載論文
【題 名】 Essential roles of heparan sulfate endosulfatase Sulf1 in reward and aversion learning through distinct dopamine D1 and D2 receptor pathways in male mice
(ヘパラン硫酸エンドスルファターゼSulf1はドーパミンD1・D2受容体経路を介した報酬と嫌悪の学習に必要である)
【著者名】 Ken Miya1,2, Kent Ohta3,4, Kazuko Keino-Masu1,2, Takuya Okada1,2, Seiya Mizuno5, Satoru Takahashi5, Tom Macpherson3,6, Takatoshi Hikida3,4, Masayuki Masu1,2
1Graduate School of Comprehensive Human Sciences, University of Tsukuba
2Department of Molecular Neurobiology, Institute of Medicine, University of Tsukuba
3Laboratory for Advanced Brain Functions, Institute for Protein Research, the University of Osaka
4Graduate School of Medicine, the University of Osaka
5Laboratory Animal Resource Center, Transborder Medical Research Center, Institute of Medicine, University of Tsukuba
6Graduate School and Faculty of Pharmaceutical Sciences, Kyoto University
【掲載誌】 Journal of Neurochemistry
【掲載日】 2026年1月4日(オンライン先行公開)
【DOI】10.1111/jnc.70338






