ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- モノクローナル抗体の用途を広げる革新技術 ー多重超解像可視化プローブへの迅速変換法ー
プレスリリース
2022.09.21
モノクローナル抗体の用途を広げる革新技術 ー多重超解像可視化プローブへの迅速変換法ー
概要
可視化対象分子に対し迅速に結合解離を繰り返す蛍光プローブを用いる超解像顕微鏡(※1)IRIS(※2)は、通常の抗体染色では不可能な高密度で高精細な分子分布画像を作ります。しかし、個別の観察対象に対するプローブを作るのに手間がかかることが問題でした。
京都大学大学院生命科学研究科 渡邊直樹 教授(同医学研究科 教授兼務)、宮本章歳 同助教、張千里 同博士課程学生らの研究グループは、大阪大学蛋白質研究所の高木淳一 教授、有森貴夫 准教授らとの共同研究で、無制限の多重染色が可能な超解像顕微鏡IRISのための蛍光プローブを、既存の抗体を改造することによって迅速に作製する方法を開発しました。多くのタンパク質は1細胞あたり数万~数100万個存在します。そのほとんど全ての位置を可視化し、多種類の分子間で比較できる顕微鏡の実用化、普及に向けた大きな一歩となることが期待されます。
本研究の技術を用いることで、医療用、研究用に開発された数多くのモノクローナル抗体(※3)を、超解像顕微鏡用を中心とした多種抗原検出に有用な蛍光プローブに効率良く転換できます。
本成果は、2022年9月20日(現地時刻)に国際学術誌「Cell Reports Methods」にオンライン掲載されます。
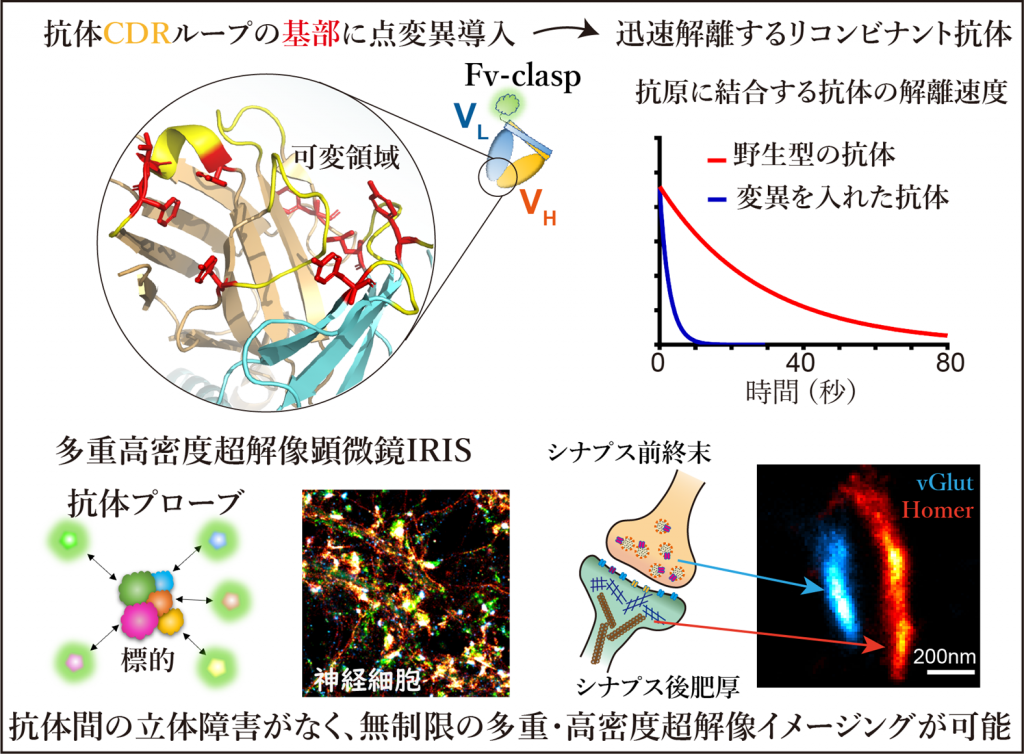
抗体フラグメント改変プローブによるIRIS超解像イメージングの概要
1.背景
2014年にノーベル賞を受賞した超解像顕微鏡は、20ナノメーター近い分解能で生体分子の分布の可視化します。しかし、抗体や蛍光タンパク質で観察対象を標識する超解像顕微鏡は、分解能が上がったゆえに、標識の密度限界に起因する「まだらな」粗い画像がかえって目立ってしまう「超解像ジレンマ」に苦しんできました。細胞や生体の中の微細構造が、真に正しい本来の形で捉えられているのか懸念されてきたわけです。
この問題を克服すべく、本研究グループは、観察対象に迅速に結合・解離を繰り返す蛍光プローブで高密度標識を実現する超解像顕微鏡IRISを開発してきました(Kiuchi et al. Nature Methods 12: 743-746, 2015)。加えて、IRISは無制限の多重染色も実現します。これらの優れた性能をもつIRISですが、各々の観察対象を可視化するための蛍光プローブを個別に作らなければならず、その作業は簡単なものではありませんでした。
一般的な超解像顕微鏡では、通常の免疫染色と同様に、検出特異性が保障済の抗体を購入すれば撮影可能です。一方で、研究用試薬あるいは医療用診断薬・治療薬として、多数のモノクローナル抗体が開発されつつあり、一部については抗体の配列情報がデータベース等に公開されています。これらの抗体をIRISでもそのまま用いることができれば望ましいのですが、抗体と抗原の親和性は一般に強く、一旦結合すると数分~数時間解離しないものがほとんどです。そのため、点描のごとく微細構造を染め上げるIRISには役に立ちません。
本研究では、大阪大学蛋白質研究所の高木淳一研究室で開発された抗体の抗原認識部位を安定的にリコンビナント化(※4)するFv-clasp(※5)技術に、抗体間に保存された特徴的なアミノ酸配列に着目した新しい点変異導入法を組み合わせることで、既存の抗体から解離時間を秒単位にまで高めた人工蛍光プローブを迅速に作製する手法の開発に成功しました。
2.研究手法・成果
本研究では、既に特異性や免疫染色における有用性が証明されているモノクローナル抗体を改変し、IRISに必要な抗原から迅速に解離するリコンビナント蛍光プローブに変換する方法の樹立を試みました。まず、抗体の抗原認識部位であるFv領域の性質を保持したまま、高いタンパク質生産性を実現するFv-claspと呼ばれる小型化フラグメント抗体フォーマットを採用しました。これに蛍光タンパク質を融合することで、アミノ酸配列の改変体を数多く作ることができ、蛍光単分子イメージングによって解離速度を効率よく評価できました。抗体のFv領域には、相補性決定領域(complementarity determining region:CDR)と呼ばれる多様性に富む配列が重鎖・軽鎖にそれぞれ3カ所ずつ有り、抗原との接触面を形成します。一般に親和性を変化させたい場合、直接相互作用するアミノ酸に変異をいれます。しかし、抗原と抗体断片との共結晶構造が報告されている場合を除き、抗原と直接相互作用するアミノ酸は不明です。そこで、われわれはFv領域に保存されたアミノ酸のうち、Fv領域の構造を保つフレームワーク領域からは外れており、CDRの形状には影響を与える可能性が高いものがあることに着目しました。選別されたアミノ酸の変異を複数組み合せることによって、Fv-clasp断片の抗原からの解離が数倍~数百倍速くなり、解離の半減期を数秒以内にまで速めることに成功しました。抗原との接触面の中心にあるアミノ酸を改変しないため、高い確率で結合特異性が保たれるのが本法の長所であると考えています。
さらに、ラクダ科の動物が産生する重鎖のみからなる小型抗体ナノボディーでも、同様のアミノ酸を検索し、それらの変異を組み合わせることで、IRISに適した迅速解離型の蛍光プローブに転換できることを確認しました。これらの得られた蛍光プローブを用いたIRISは、4ないし7重の多重超解像染色を実現するのみならず、以下の図の例に示す通り、従来の超解像顕微鏡では実現されない忠実度の高いイメージングに成功しています。
【図1】
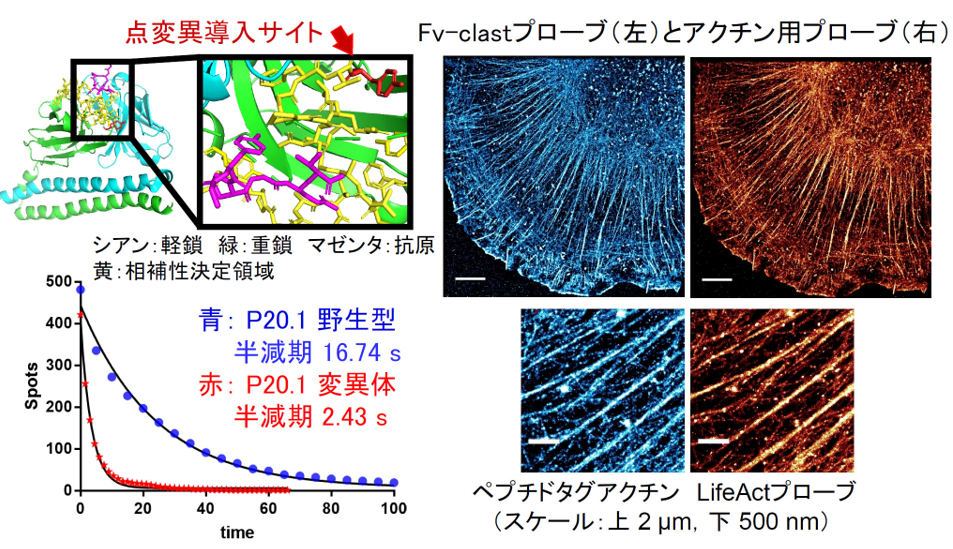
Fv-clasp化された抗体フラグメント(左上)に点変異をいれることで、抗原(ペプチド)からの解離速度を約7倍上昇させることに成功した例です。このペプチドを付加したアクチンを発現する培養細胞を使い、アクチン線維可視化用プローブであるLifeActと比較したところ、遜色ないIRIS超解像画像が得られました。
【図2】
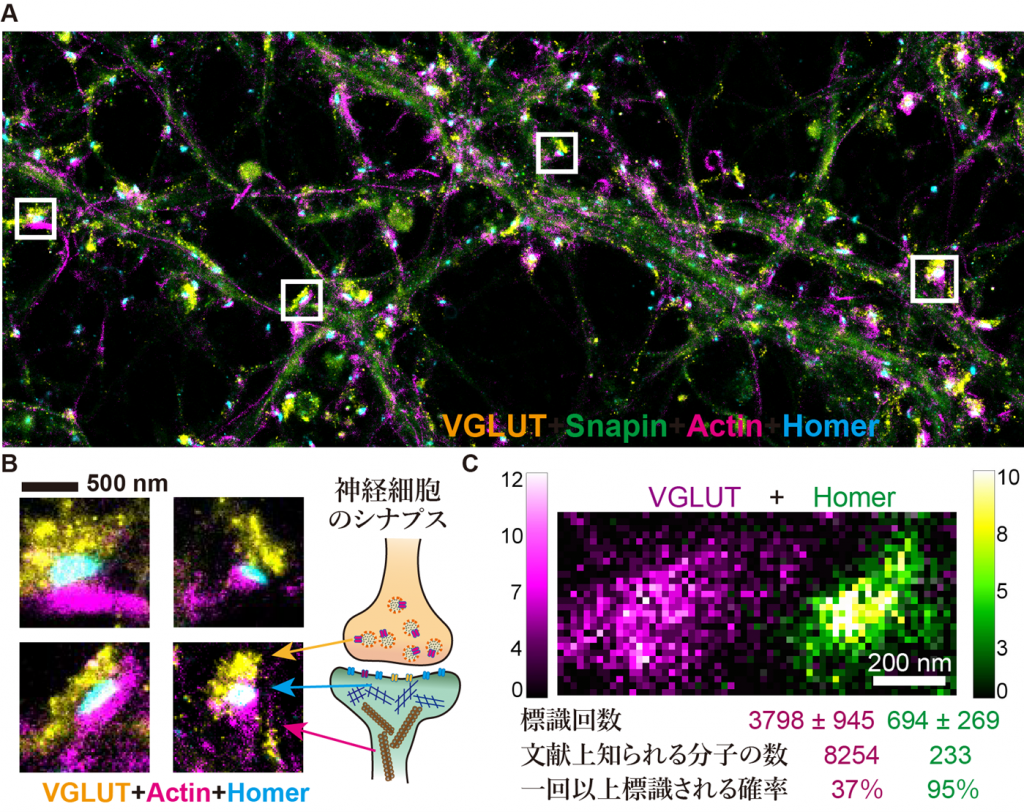
IRISによる培養神経細胞の四重染色超解像イメージング。(A)全体像。(B)神経シナプスの拡大像。前シナプスの小胞型グルタミン酸トランスポーター(VGLUT)、シナプス後肥厚内のアダプター分子Homerとそれを取り囲む豊富なアクチン線維が可視化されています。(C) HomerとVGLUTに対する新規IRISプローブが各シナプスで対象分子を標識した回数(10個の平均)は、各々の分子数近くまで到達していました。超解像顕微鏡では、標識密度が十分でないと正しい分子分布が画像化されません。
【図3】
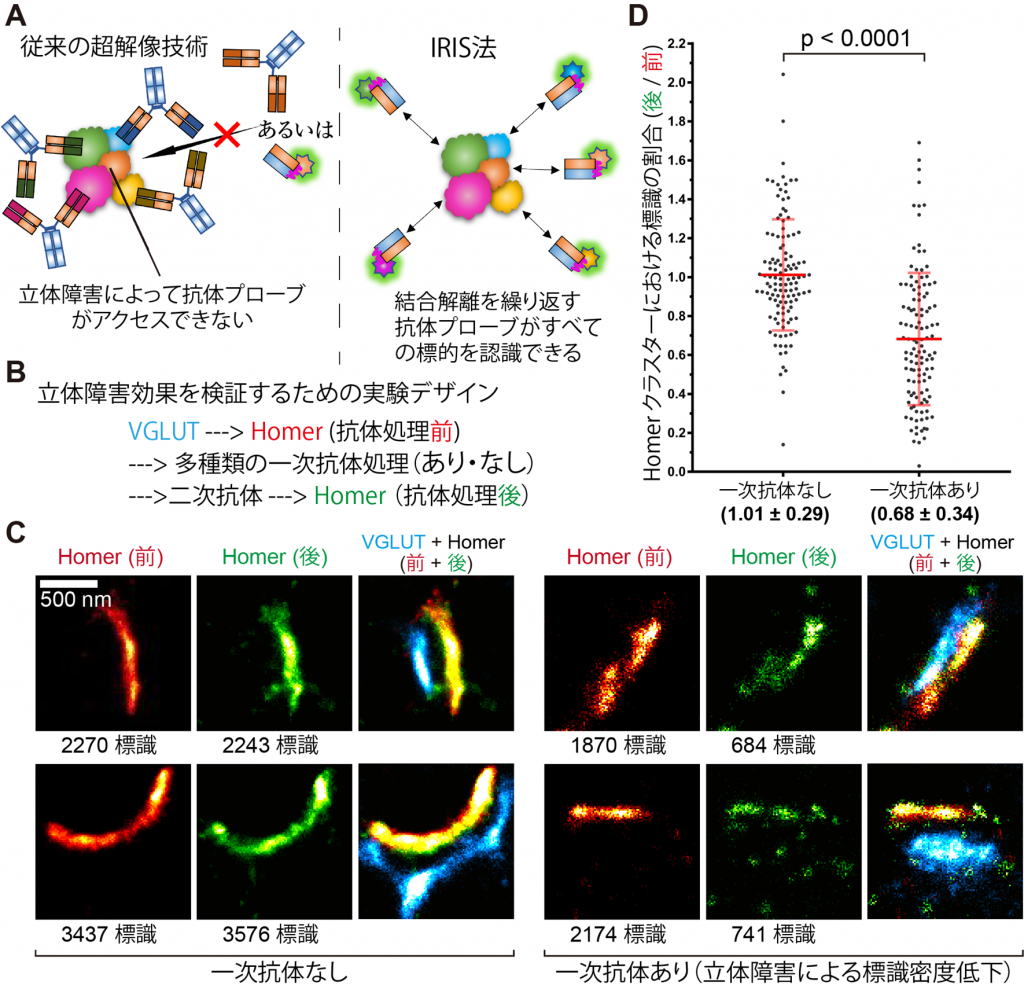
多重染色におけるIRISの優位性の証明。得られたHomer用IRISプローブを用いて、複数の抗体を組み合わせる多重染色の問題点を検証しました。Homerの近傍に存在する3種の分子に対する抗体で培養神経細胞標本を処理すると、処理前に比べ32%各シナプスにおけるHomer用プローブの標識密度が低下しました。抗体同士の空間的干渉によって互いの抗原へのアクセシビリティーが低下することが示唆されます。IRISでは、このような影響を受けずに多重染色が可能です。
3.波及効果、今後の予定
多重高密度標識超解像顕微鏡IRISは、観たい対象分子ごとに特殊な蛍光プローブを作らなければならない点がボトルネックとなり普及が妨げられてきました。今回の研究によって、既存の抗体のアミノ酸配列から高い効率でIRISに適した迅速結合・解離型のリコンビナントプローブが取得可能になりました。抗体の配列情報が得られれば1月程でIRIS用プローブに変換できます。
近年、従来型の超解像顕微鏡の普及にともない、細胞や生体の多くの構造が可視化されてきました。しかし、抗体による観察対象の標識が不完全なため、微細構造の形を忠実に再現することや分子分布を完全に検出するイメージングは未だ困難です。そのためか、例えば分子の位置関係については、多くの論文で複数の画像からデータが抽出され、統計的に解釈されています。生体構造や分子複合体のありのままの姿をタンパク質のサイズに近い分解能で可視化し、その場ごとの「個性」として捉えることができれば、さらに素晴らしい発見につながるかもしれません。
今回示したように、IRISは細胞内に存在するタンパク質分子の数に匹敵する標識密度を実現しています。そして、多くの種類のタンパク質を抗体同士の空間的干渉に邪魔されることなく、同じ視野内で可視化し比較することができます。今後、様々な分子を標的にしたIRIS用蛍光プローブが開発されることで、生体分子が絡み合って機能する本当の姿がわかってくることが期待されます。
4.研究プロジェクトについて
本研究は下記の支援を受けて実施されました。
渡邊直樹:科学技術振興機構(JST) 戦略的創造研究推進事業(CREST)研究領域「統合1細胞解析のための革新的技術基盤」 研究課題「多重高密度超解像顕微鏡IRISによる多分子複合体マッピング」 JPMJCR15G5(研究代表)、科研費 基盤研究(A) 22H00456(研究代表)
木内泰:科研費 基盤研究(C) 21K06168(研究代表)、新学術領域研究(研究領域提案型) 19H04961(研究代表)
張千里:小林財団特別研究奨励金
高木淳一:日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「Structure-based protein designを駆使した抗体代替物の創成と高難度組換え蛋白質生産の支援」21am0101075j0005(研究代表)
用語解説
※1 超解像顕微鏡:
光の回折限界に起因する光学顕微鏡の原理的な分解能200 nmを超えた空間分解能を発揮する蛍光顕微鏡。分子ローカリゼーション法(PALM/STORM/DNA-PAINT(※6)等)、構造化照明法(SIM)、誘導放出制御法(STED/RESOLFT)を含む複数の方式が考案されています。
※2 多重高密度標識超解像顕微鏡IRIS:
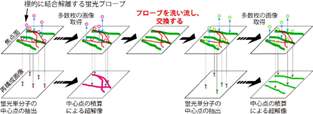 渡邊研究室が発案した高密度標識による精細な画像と無制限の多重染色を実現する超解像顕微鏡(Kiuchi et al. Nature Methods 12: 743-746, 2015)。図に示すように、観察対象に迅速に結合・解離を繰り返す蛍光プローブを用い、その結合部位を分子ローカリゼーション法に準じた方法で積算し画像化します。サンプリング定理が示すように、標識間隔の2倍以下の形状は正しく認識できません。抗体や蛍光タンパク質で標識する通常の超解像顕微鏡より、高密度で観察対象を標識可能なIRISを用いることで、この問題は解決可能です。
渡邊研究室が発案した高密度標識による精細な画像と無制限の多重染色を実現する超解像顕微鏡(Kiuchi et al. Nature Methods 12: 743-746, 2015)。図に示すように、観察対象に迅速に結合・解離を繰り返す蛍光プローブを用い、その結合部位を分子ローカリゼーション法に準じた方法で積算し画像化します。サンプリング定理が示すように、標識間隔の2倍以下の形状は正しく認識できません。抗体や蛍光タンパク質で標識する通常の超解像顕微鏡より、高密度で観察対象を標識可能なIRISを用いることで、この問題は解決可能です。
(京都大学プレスリリース参照:https://www.kyoto-u.ac.jp/ja/research-news/2015-07-07)
※3 モノクローナル抗体:
単一の抗体産生細胞をクローニングして作られた抗体。
※4 リコンビナント化:
タンパク質をコードする遺伝子を発現ベクター上に組換えDNA(リコンビナントDNA)としてクローニングし、タンパク質の発現、精製に用いること。
※5 Fv-clasp:
大阪大学高木淳一研究室で開発されたフラグメント抗体フォーマット(Arimori et al. Structure 25, 1611-1622, 2017)。抗体のFv領域を構成する重鎖および軽鎖の断片に、ヒトMst1がもつSARAHドメインを融合することで安定性の高い二量体が得られ、高い生産性を実現します。
※6 DNA-PAINT:
DNAオリゴマーで修飾した特殊抗体を用いる超解像顕微鏡法。蛍光色素を付けた相補的なDNAオリゴマーを一時的に結合させ、分子ローカリゼーション法によるイメージングを行います。異なるDNAオリゴマーで修飾した抗体を順次撮影することで、無制限の多重染色を実現します。しかし、標識密度をIRISのように高めることはできず、多重染色では抗体間の空間的干渉による標識密度の低下が起こり得ます。
論文情報
タイトル:Engineered fast-dissociating antibody fragments for multiplexed super-resolution microscopy(多重超解像顕微鏡のための迅速解離改変抗体断片)
著 者:Qianli Zhang, Akitoshi Miyamoto, Shin Watanabe, Takao Arimori, Masanori Sakai, Madoka Tomisaki, Tai Kiuchi, Junichi Takagi and Naoki Watanabe
掲 載 誌:Cell Reports Methods DOI:10.1016/j.crmeth.2022.100301
【蛋白質研究所】研究者紹介:有森 貴夫准教授

有森 貴夫准教授
―ひと言コメントをお願いいたします―
我々が開発したFv-claspという技術が非常に優れたイメージングの技術に活かされたことが大変嬉しく思います。






