ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- ラミニンとインテグリンがマクロファージを樹状細胞様細胞に変化させるメカニズムを解明 ―がん免疫療法への応用の可能性ー
プレスリリース
2025.08.19
ラミニンとインテグリンがマクロファージを樹状細胞様細胞に変化させるメカニズムを解明 ―がん免疫療法への応用の可能性ー
新潟大学大学院医歯学総合研究科口腔保健学分野の吉羽永子教授と、同研究科高度口腔機能教育研究センターの前川知樹研究教授らを中心とした研究グループは、大阪大学蛋白質研究所の関口清俊寄附研究部門教授と共同で免疫細胞であるマクロファージが樹状細胞様細胞へと変化する新たなメカニズムを解明しました。本研究では、細胞外マトリックス成分のラミニン(注1)α2鎖とその受容体であるインテグリン(注2)α7が、マクロファージの樹状細胞様細胞への分化プロセスにおいて重要な役割を果たしていることが明らかになりました。特に、インテグリンα7の結合が阻害されると、マクロファージは樹状細胞様細胞に変化することが確認されています。この発見は、インテグリンα7を標的とした腫瘍治療の新たなアプローチにつながる可能性があり、がん治療や免疫療法における新たな道を切り開くものとして期待されます。
Ⅰ.研究の背景
- 【本研究成果のポイント】
- ▶︎インテグリンα7の機能阻害により、マクロファージが樹状細胞様の形態と機能を獲得することを明らかにした。
- ▶︎インテグリンα7阻害はPI3K/AKT経路を活性化し、樹状細胞への分化を促進する分子機構を明らかにした。
- ▶︎ラミニンα2を用いた細胞培養基質が、樹状細胞の誘導効率を向上させることを明らかにした。
- ▶︎ラミニンα2とインテグリンα7の相互作用が樹状細胞の分化に関与し、免疫療法への応用の可能性を示した。
私たちの体の中では、細胞が正しく働くために「足場」となる物質が必要です。その足場のひとつに「ラミニン」という蛋白質があります。ラミニンは現在、人では19種類が知られています。その中でも「ラミニンα2」という鎖を持つタイプは、特に神経や筋肉で多く見られます。
また、体の中で免疫の働きをしている「マクロファージ」という細胞は、病気を防いだり、傷を治したりするために、周りの環境に応じて性質を変えることができます。このマクロファージもラミニンを足場にして働くと考えられますが、これまでその関係についてはよくわかっていませんでした。
Ⅱ.研究の概要
本研究では、ラミニンα2鎖に最も強く結合する受容体である「インテグリンα7」の機能を失わせることで、免疫細胞の一種であるマクロファージが、樹状細胞様の性質を獲得することが明らかになりました。樹状細胞は、異物から取り込んだ抗原を細胞表面に提示し、T細胞など他の免疫細胞に情報を伝える「司令塔」ともいえる存在です。
実験では、ラミニンα2でコートした培養プレート上でインテグリンα7の働きを阻害すると、球状だったマクロファージから木の枝のような突起が伸び出し、樹状細胞の様な形態へと変化しました(図1)。
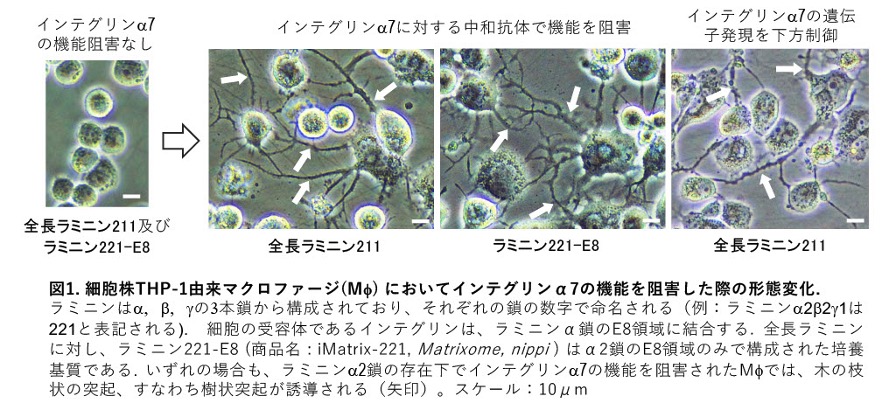
これらの細胞は、活発な食作用を持ち、樹状細胞に特有の多くの遺伝子や分子を発現し、さらにT細胞を活性化させる能力も備えていることが確認されました。また、この変化には、細胞内のシグナル伝達経路である「PI3K」および「AKT」が関与していることも明らかとなりました。
また、末梢血から分離した単球は、通常、GM-CSFというサイトカインの刺激によりマクロファージに分化し、さらにIL-4を加えることで樹状細胞に分化することが知られています。ところが、ラミニンα2でコートしたプレート上で単球を培養すると、IL-4を加えなくても樹状細胞様細胞に分化することが明らかになりました (図2)。
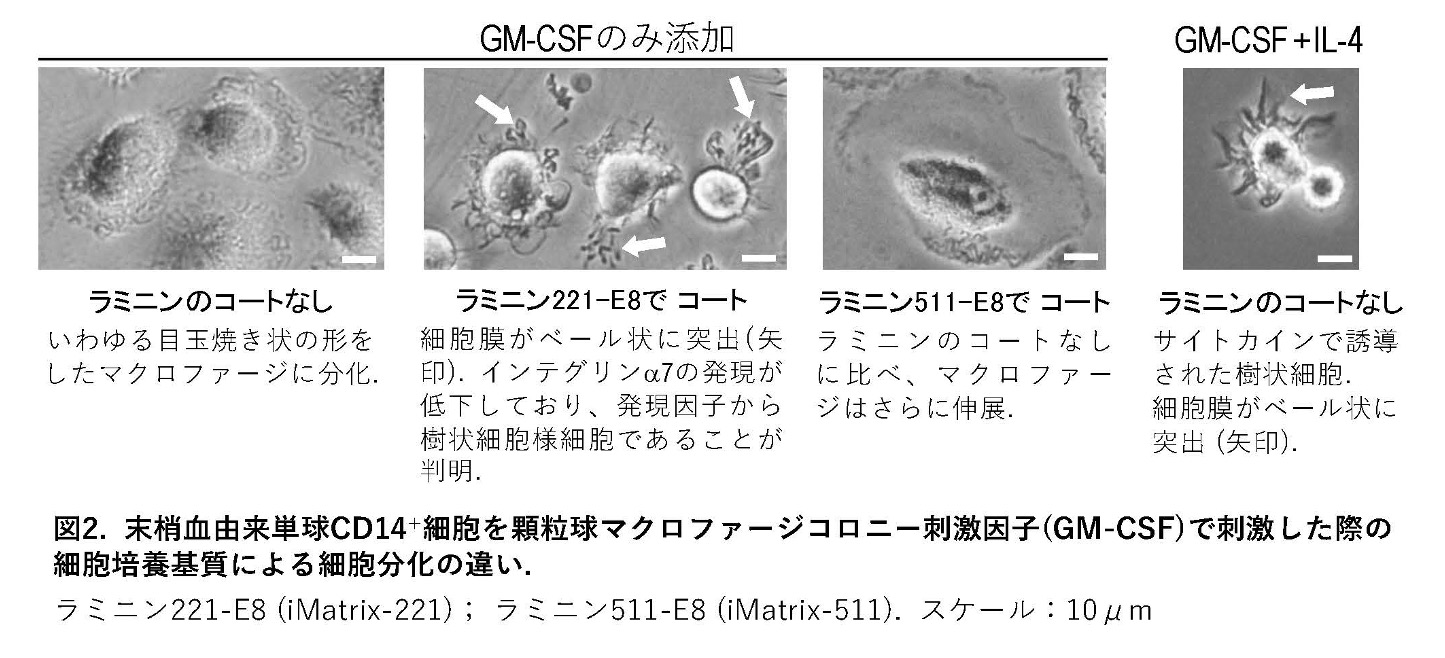
これらの結果から、これまで「サイトカイン」と呼ばれる免疫調節物質が中心的役割を果たすと考えられてきた樹状細胞の分化において、実はラミニンα2やインテグリンα7といった細胞接着環境も重要な要素であることが示されました。
インテグリンα7は、がん治療のターゲットとしても注目されており、本研究の成果は、将来的にがん免疫療法などへの応用が期待されます。
Ⅲ.研究の成果
インテグリンα7を機能的に阻害すると、マクロファージが樹状細胞様の形態をとり、樹状細胞マーカーや共刺激分子の発現が上昇し、T細胞の増殖を誘導する能力を獲得することが明らかになりました。また、PI3K-AKT経路を介したシグナル変化も確認され、細胞接着による分化制御の分子機構が示されました。これにより、インテグリンα7は免疫細胞の機能制御における新たな標的となり得ること、さらにがん免疫療法における樹状細胞誘導の手法として応用可能であることが示唆されました。
Ⅳ.今後の展開
本研究により、インテグリンα7とラミニンα2鎖との相互作用がマクロファージの樹状細胞様分化を誘導する新たな経路であることがわかりました。インテグリンα7の機能を阻害することで、この分化が促進される可能性があり、今後はこの経路を応用した免疫細胞の操作技術の開発が期待されます。特に、インテグリンα7を標的とした抗体治療や低分子阻害剤の開発は、がん免疫療法における樹状細胞ワクチンや抗腫瘍免疫の誘導に活用できる可能性があります。また、ラミニンα2を用いた細胞培養基材やバイオマテリアルの設計によって、樹状細胞の誘導効率を高める新たな免疫治療プラットフォームの構築も視野に入リます。さらに、インテグリンα7の発現や機能を指標とした診断マーカーや治療効果予測因子としての応用も期待されます。
Ⅴ.研究成果の公表
本研究成果は、2025年7月21日、国際科学誌「Journal of Biological Chemistry」のオンライン版に掲載されました。
【論文タイトル】Loss of integrin alpha7-mediated signaling induces a dendritic cell-like phenotype in macrophages cultured on laminin-211/221 isoforms.
【著者】Nagako Yoshiba, Tomoki Maekawa, Kiyotoshi Sekiguchi, Masaru Kaku, Kridtapat Sirisereephap, Meircurius Surboyo, Yurie Sato-Yamada, Andrea Rosenkranz, Akihiro Hosoya, Naoto Ohkura, Yoshito Kakihara, Takeyasu Maeda, George Hajishengallis, Kenji Izumi, Kunihiko Yoshiba
【doi】https://doi.org/10.1016/j.jbc.2025.110419
Ⅵ.謝辞
本研究は、科研費基盤(B)(22H03259、22H03267)、学術変革領域研究(A)(23721401)、文部科学省科学技術人材育成費補助事業「新潟大学ダイバーシティ研究環境イニシアティブ」(先端型)、大阪大学蛋白質研究所拠点事業(CR-21-07)などの支援を受けて行われました。
【用語解説】
(注1)ラミニン:α鎖、β鎖、γ鎖が会合した十字架の様な構造をしています。α鎖は5種類 (α1-α5)、β鎖は3種類 (β1-β3)、γ鎖には3種類(γ1-γ3)あり、代表的な接着性マトリックスとして、基底膜を構成しています。知られている19種類のラミニンアイソフォームは組織特異的に局在し、細胞の表現型や分化パターンを調節しています。
(注2)インテグリン:細胞外マトリックスのレセプターとして細胞内部の骨格をつなぎ、細胞の動きや形態維持において不可欠な役割を果たしています。αとβサブユニットからなり、ラミニンに結合するインテグリンとしてはα7β1、α3β1、α6β1、α6β4の4種類があります。ラミニンアイソフォームに対するインテグリンの親和性はそれぞれ著しく異なることが知られています。






