ACHIEVEMENTS
![]()
ACHIEVEMENTS研究成果
-

- ACHIEVEMENTS
- 赤外光駆動型光合成をクライオ電顕で捉える -低いエネルギーで通常の光化学反応が駆動される仕組み-
プレスリリース
2021.04.21
赤外光駆動型光合成をクライオ電顕で捉える -低いエネルギーで通常の光化学反応が駆動される仕組み-
兵庫県立大学大学院理学研究科の伊藤(新澤)恭子特任教授、菓子野(井上)名津子客員教員(助教)、菓子野康浩准教授、理化学研究所(理研)放射光科学研究センター利用技術開拓研究部門生体機構研究グループの浜口祐研究員、川上恵典研究員、米倉功治グループディレクター(東北大学多元物質科学研究所 教授等を兼任)、名古屋大学の伊藤繁名誉教授、京都大学大学院農学研究科の伊福健太郎教授、大阪大学蛋白質研究所の山下栄樹准教授の共同研究グループ※は、クライオ電子顕微鏡[1]を用いて、近赤外光を吸収するクロロフィルd[2]を主色素として光合成を行うアカリオクロリス・マリナ(Acaryochloris marina)[3]の光化学系Ⅰ(系Ⅰ)複合体の構造を明らかにすることに成功しました。
クロロフィルdの励起によって得た近赤外光のエネルギーは、他の酸素発生型光合成生物で用いられるクロロフィルa[2]より80mVも低いため、アカリオクロリス・マリナの光合成がどのような仕組みで他の酸素発生型光合成と同じように進むことができるのか、詳しい仕組みは明らかではありませんでした。
本研究により、アカリオクロリス・マリナの系Ⅰ複合体の立体構造が明らかになったことで、低いエネルギーで通常の系Ⅰと同様の反応を達成する仕組みが解明され、本研究の成果は太陽光に多量に含まれる赤外光を利用した人工光合成の開発といった応用につながると期待できます。
今回、共同研究グループは、冷陰極電界放出型の電子銃を備えた新型の国産クライオ電子顕微鏡を用いて、アカリオクロリス系Ⅰ複合体の原子構造を2.58オングストローム(Å、1Åは100億分の1メートル)分解能での決定に成功しました(図1)。
本研究は、オンライン科学雑誌『Nature Communications』(4月20日付:日本時間4月20日午後6時)に掲載されました。
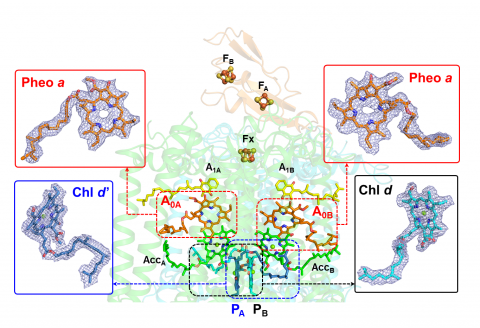
図1.本研究で明らかにされたアカリオクロリス系Ⅰ複合体(中央)と電子伝達反応の中核となる色素(両端)
PAPBが反応中心の2量体クロロフィルd/d’、A0AA0Bが第一次電子受容体フェオフィチンa。
共同研究グループ
兵庫県立大学 大学院理学研究科 細胞構造学分野
准教授 菓子野 康浩(かしの やすひろ)
特任教授 伊藤(新澤)恭子(いとう・しんざわ きょうこ)
客員教員(助教) 菓子野(井上)名津子(かしの・いのうえ なつこ)
理化学研究所 放射光科学研究センター
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治 (よねくら こうじ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 理研-JEOL連携センター次世代電子顕微鏡開発連携ユニット ユニットリーダー)
(東北大学 多元物質科学研究所 教授)
研究員 川上 恵典 (かわかみ けいすけ)
研究員 浜口 祐 (はまぐち たすく)
名古屋大学
名誉教授 伊藤 繁 (いとう しげる)
京都大学 大学院農学研究科 植物栄養学分野
教授 伊福 健太郎 (いふく けんたろう)
大阪大学 蛋白質研究所
准教授 山下 栄樹 (やました えいき)
研究支援
本研究は、文部科学省科学研究費補助金「新学術領域研究:光合成分子機構の学理解明と時空間制御による革新的光 ― 物質変換系の創製(I4LEC)」(課題番号:18H05175(公募)、研究代表者:菓子野康浩;課題番号:20H05109(公募)、研究代表者:川上恵典)、「新学術領域研究:新光合成:光エネルギー変換システムの再最適化」(課題番号:16H06554、研究代表者:伊福健太郎)日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)(研究代表者:米倉功治)日本学術振興会(JSPS)・科学研究費補助金「基盤研究C」(課題番号:20K06515、研究代表者:浜口祐;課題番号:20K06528、研究代表者:川上恵典)などによる支援を受けて行われました。
1.背景
クロロフィルによって吸収された光エネルギーによって、反応中心と呼ばれる特殊なクロロフィル2量体の励起が光合成の起爆点(光化学反応)になります。ほとんどの酸素発生型光合成生物では、可視光を吸収するクロロフィルaがその役目を担います。一方、1996年に宮下らにより初めて見出されたアカリオクロリス・マリナ(Acaryochloris marina)の主色素はクロロフィルdです。クロロフィルdによる光化学反応は、近赤外光により駆動されるため、クロロフィルaに比べて80mVもエネルギーが小さくなります。
酸素発生型光合成の光化学反応には光化学系Ⅰ(系Ⅰ)と光化学系Ⅱ(系Ⅱ)の2種類があり、系Ⅱは水を分解して酸素を発生し、得られた電子を受け取った系Ⅰにより、還元力を持つNADPH[4]が生成されます。アカリオクロリス・マリナの発見から、およそ四半世紀の間、生化学的・分光学的解析が進められてきましたが、近赤外光の小さなエネルギーで他の酸素発生型光合成生物と同様の反応が遂行されるメカニズムの理解には至っておらず、反応の詳細なメカニズムの解明が待たれていました。
2.研究手法と成果
理研が所有するクライオ電子顕微鏡装置(日本電子社CRYO ARM 300)は、干渉性の高い電子ビームを発生する冷陰極電界放出型の電子銃を備え、従来型の装置に比較して、少ない数の像から精度良く高い分解能の構造を取得できます。
共同研究グループは、この新型クライオ電子顕微鏡を用いた単粒子解析法[5]により、11種類の蛋白質から構成され、分子の大きさがおよそ70万ダルトンにもなる超複合体アカリオクロリス・マリナ系Ⅰ複合体(3量体)の立体構造を2.58オングストローム(Å、1Åは100億分の1メートル)分解能で決定しました(図2)。
この立体構造決定により、電子伝達鎖が明らかになりました。反応中心はクロロフィルd/d’[6]で、原子レベルでの配位情報が示されました。今回の解析で得られた最も大きな発見は、第1次電子受容体(A0)がフェオフィチン[7]aであったことです。これまで解析されてきた他の光合成生物の系Ⅰにはフェオフィチンaは無く、いわゆるタイプⅠ型反応中心[8]と異なることが明らかとなりました。
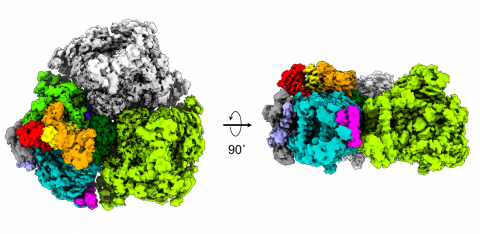
図2.系Ⅰ(3量体)のクライオ電子顕微鏡像。
(左)チラコイド膜内腔側から見た像。
(右)側面から見た像。モノマー1、多重色;モノマー2、緑;モノマー3、グレー。
このような特異性が、クロロフィルaによる系Ⅰの反応と同様の機能をエネルギーの小さな赤外光で実現することができる背景とみられます。A0に続く電子伝達鎖は、他の生物の系Ⅰと同様のフィロキノン(A1)、Fx、FA、FBと連続する3つの4鉄4イオウ型鉄イオウセンター[9]であり、このことにより、他の光合成生物のようにフェレドキシンへの電子伝達が保証されるものと考えられます。
また、系Ⅰ複合体を構成する11種類に上るサブユニットタンパク質の立体的配置とともに、系Ⅰ複合体内のクロロフィルとカロテノイドの配置も明らかになりました(図3)。他の生物の系Ⅰとほぼ対応した位置に、クロロフィルaの代わりにクロロフィルdが配置し、その結合を安定化させるようにアミノ酸が配位していることが示されました。概ね他の系Ⅰに対応していましたが、明らかに欠如したものがあり、他の系Ⅰではβ-カロテンであるものがα-カロテンであるなど、特徴的な光合成色素配置がみられました。このような特徴も、エネルギーの低い近赤外光を有効に補修するための仕組みと考えられます。
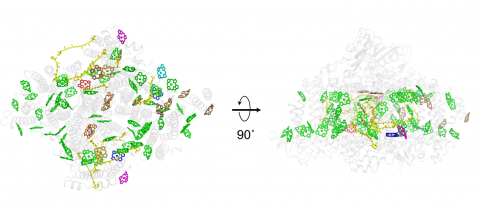
図3.アカリオクロリス・マリナ系Iの光合成色素分布
左: チラコイド膜のストロマ側から見た図。
右: 左の図を横方向に反時計回りに90o回転させたもの(チラコイド膜に沿った断面図)。
各色素は、そのリガンドに応じて色分けされている(緑: His、茶: 水分子、赤: Asp、マゼンタ: Glu、シアン: フォスファチジルグリセロール)。黄は、カロテノイド。
アカリオクロリス・マリナの系Ⅰは、クロロフィルのほとんどはクロロフィルdであり、光化学反応自体をクロロフィルdが赤外光エネルギーのエネルギーレベルで担っているという際立った特徴があります。このような系Ⅰの構造が明らかになったことは、これまでにありませんでした。
3.今後の期待
今回、エネルギーの低い近赤外光で光化学反応が駆動され、通常の酸素発生型光合成が行われるアカリオクロリス・マリナの系Ⅰ複合体の立体構造が、初めて明らかになりました。これは、近赤外光を利用する酸素発生型光合成生物という生態学的にも重要な位置づけにある生物の、エネルギー獲得の仕組みの一端を明らかにしたことになります。そして、酸素発生型光合成生物がすべて可視光吸収型クロロフィルaを主色素として利用している中で、エネルギーの低いクロロフィルdを獲得して、その低いエネルギーで通常の酸素発生型光合成を実現することができるようになった進化上の問題解決にも、本研究の結果はとても有用です。
そして、本研究結果は、太陽光の中にふんだんに含まれている近赤外光を有効に利用する太陽電池や人工光合成等への応用開発が期待できます。
4.論文情報
<タイトル>
Structure of the far-red light utilizing photosystem I of Acaryochloris marina
<著者名>
Tasuku Hamaguchi, Keisuke Kawakami, Kyoko Shinzawa-Itoh, Natsuko Inoue-Kashino, Shigeru Itoh, Kentaro Ifuku, Eiki Yamashita, Kou Maeda, Koji Yonekura and Yasuhiro Kashino
<雑誌>
Nature Communications
<DOI>
https://doi.org/10.1038/s41467-021-22502-8
5.補足説明
[1] クライオ電子顕微鏡
タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らすことができる。Jacques Dubochetはこの氷包埋法を開発し、2017年のノーベル化学賞の受賞者の一人に選ばれた。
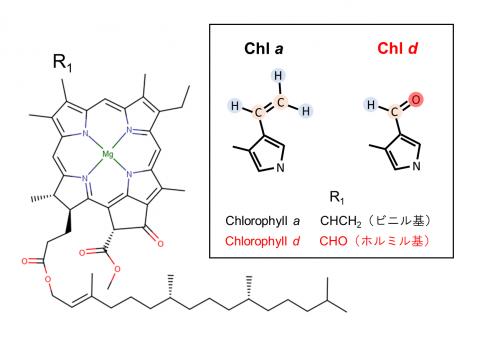
[2] クロロフィルa、d
葉緑素。クロロフィルaは高等植物を含むほとんどの酸素発生型光合成生物で主色素として機能している。クロロフィルdは、クロロフィルaのビニル基がホルミル基に置換された構造(枠内図、右)で、赤外光を吸収する。この特性により、アカリオクロリス・マリナの系Ⅰは酸素発生型光合成生物の系Ⅰよりも長波長の光を吸収することができる(枠内図、左)。
[3] アカリオクロリス・マリナ(Acaryochloris marina)
(株)海洋バイオテクノロジー研究所の宮下英明博士(現京都大学教授)らにより、パラオでホヤに共生し、クロロフィルdを主色素とするシアノバクテリアの一種として見出され、1996年に報告された。クロロフィルdは、1950年代に報告があったものの、その後自然界で確認されることがなく、クロロフィルaの変性したものとの理解が広がっていた。しかし、アカリオクロリス・マリナの発見により、自然界でのクロロフィルdの存在が再確認されたという経緯がある。
[4] NADPH
還元力を有する分子で、還元力を必要とする生体内の生化学反応に還元力を提供する。
[5] 単粒子解析法
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。結晶を作製しなくても分子の構造が得られる。技術革新により、理想的な試料ではX線結晶構造解析に勝る空間分解能で構造が決定できるようになった。2017年のノーベル化学賞受賞者の一人、Joachim Frankらにより単粒子解析法の基礎が作られた。
[6] クロロフィルd ’
クロロフィルdのエピマー。クロロフィルには3個の不斉炭素があり、その不斉炭素による幾何異性体のひとつ。
[7]フェオフィチン
クロロフィルの閉環ピロール環に配位しているMg2+が欠落したもの。対応するクロロフィルに応じて、フェオフィチンa、フェオフィチンd、と呼ばれる。本研究で確認されたものは、フェオフィチンa。クロロフィルを弱い酸に晒すことでも得られるが、自然界にも存在する。
[8] タイプⅠ型反応中心
光合成細菌ヘリオバクテリアのような光化学系Ⅰ類似の反応中心を包含した類型の呼称。ヘリオバクテリア等の反応中心は、光化学系Ⅰ反応中心の祖型と考えられている。紅色光合成細菌の反応中心のような光化学系Ⅱ類似の反応中心を包含した類型をタイプⅡ反応中心と呼ぶ。
[9] 4鉄4イオウ型鉄イオウセンター
鉄とイオウが立方体の各頂点に、異なる原子が隣り合う形で配位した構造で、生体内の各種電子伝達反応に関わる。光化学系Ⅰには、3つの鉄イオウセンター(FX, FA, FB)が存在する。


