研究内容
私たちの研究室では、現在、以下の4つのテーマに沿って研究を進めています。
マウス胎児の基底膜タンパク質の網羅的局在解析

細胞外マトリックスはその存在様式によって間質と基底膜に大別されます。私たちの研究室では特に基底膜に注目しています。これは、基底膜がすべての多細胞動物に保存されている細胞外マトリックスのプロトタイプであり、さまざまな臓器の実質を構成する上皮細胞(血管の内皮細胞を含む)にとって基底膜が直近の足場となっているからです。
私たちは、トランスクリプトーム解析により基底膜を構成するタンパク質の全体像を明らかにするとともに、ほぼすべての基底膜タンパク質を網羅した抗体ライブラリーを作製して、マウス胎児の各臓器における基底膜タンパク質の局在部位を網羅的に解析し、細胞ごとにカスタマイズされた基底膜の分子的実体を明らかにしてきましたref.1。具体的には、胎生16.5日のマウス胎児の全身凍結切片をこの抗体ライブラリーで染色し、各基底膜タンパク質の局在部位を1細胞レベルで検索可能な高解像度免疫組織染色画像データベース (Mouse Basement Membrane Bodymap) を作製しました。この画像データベースはウェブ上で公開されており、誰でも閲覧することができます。
また、胎生5.5 - 7.5日の初期胚の基底膜の分子組成を網羅的に解析し、初期胚の多能性幹細胞 (epiblast) の足場となっている基底膜の主成分がラミニン511 (α5β1γ1) であることを見いだしましたref.2。この成果はラミニン511の活性フラグメントを使ったヒト多能性幹細胞(ES細胞/iPS細胞)用培養基材の開発に結実しています。
インテグリンによるラミニンの識別機構
ラミニンはα鎖、β鎖、γ鎖が1:1:1で会合したヘテロ三量体タンパク質です。哺乳動物では、5種類のα鎖 (α1〜α5) 、3種類のβ鎖 (β1〜β3) 、3種類のγ鎖 (γ1〜γ3) が存在し、それらの組み合わせが異なる16種類のラミニンが存在しています。どのラミニンを足場として使うかは細胞によって異なります。初期胚の多能性幹細胞、神経幹細胞、上皮性幹細胞はα5鎖を含むラミニンを足場としていますが、中胚葉由来の細胞はα2鎖やα4鎖を含むラミニンを足場としています。また、皮膚、食道、直腸のような重層上皮細胞はα3鎖を含むラミニン332を足場としていることもわかってきました。
ラミニンに多くの種類があるように、細胞外マトリックス受容体であるインテグリンにも多くの種類があります。インテグリンはα鎖とβ鎖と呼ばれる膜貫通タンパク質の二量体分子です。インテグリンのα鎖には18種類、β鎖には8種類あり、それらの組み合わせによって、どの細胞外マトリックス分子と結合するかが決まっています。α3鎖、α6鎖、α7鎖を含むインテグリンがラミニンと結合します。また、インテグリンがどのα鎖を含むかによって、結合するラミニンの種類が違っています。私たちは、ラミニンと結合する5種類のインテグリン (α3β1, α6β1, α6β4, α7X1β1, α7X2β1) と11種類のラミニン(ラミニン111, 121, 211, 221, 311, 321, 332, 411, 421, 511, 521)の組換えタンパク質を使い、それぞれの組み合わせの結合の強さを網羅的に解析し、ラミニンとインテグリンの結合特異性の全貌を明らかにしていますrefs.3-5。
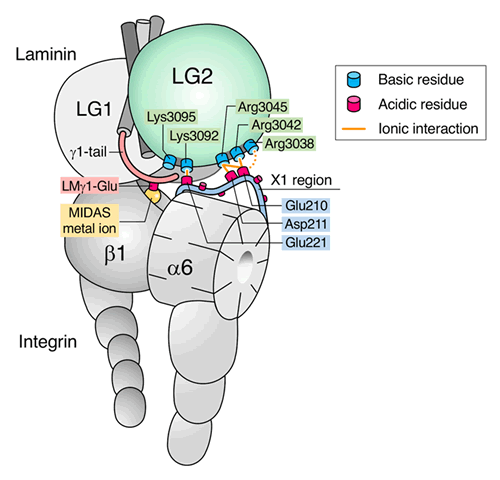
進化的には、ラミニン511とα6β1インテグリンがラミニン—インテグリン相互作用のプロトタイプであると考えられています。私たちは世界に先駆けてラミニン511の精製に成功し、そのインテグリン結合活性をほぼ100%保持した組換え断片(ラミニン511E8断片)を作製して、その結晶構造を解明しましたref.6。また、生化学手法を駆使して、インテグリンとの結合に関与するアミノ酸残基を同定し、(i) γ1鎖とγ2鎖に保存されているC末端領域のグルタミン酸残基がインテグリンβ1鎖の二価金属イオンに結合することref.6、(ii) α5鎖C 末端領域のLG2ドメインに存在する5個の塩基性アミノ酸残基がインテグリンα6鎖の酸性アミノ酸残基とイオン結合することを明らかにしました(上記のモデル参照)ref.7。私たちが提唱したラミニン-インテグリン相互作用の《二領域モデル(bipartite model)》はクライオ電子顕微鏡で解明されたラミニンーインテグリン複合体の構造により確認されていますref.8
組換えラミニン活性フラグメントを利用した次世代培養技術の開発
生体から分離した細胞を培養するとき、培養器に接着できない細胞は増殖できず、自発的に細胞死のプログラムを作動させて死滅します。この現象は<細胞増殖の足場依存性>と呼ばれ、すべての動物細胞(浮遊細胞やがん細胞を除く)に当てはまる基本的属性です。多能性幹細胞は特に足場依存性が強く、細胞をトリプシン等でバラバラにして播種すると、培養器に接着できない細胞では速やかに細胞死が誘導されます。私たちは、初期胚の多能性幹細胞の足場がラミニン511であることに着目し、ラミニン511の組換え活性断片(ラミニン511E8断片)をコーティングした培養器を使うと、バラバラにしたヒトES/iPS細胞が速やかに接着し、効率よく増幅されることを見いだしていますref.9,10。ラミニン511E8断片は "iMatrix-511" の商品名で製品化され、ヒトiPS細胞の標準的な培養基質として現在幅広く利用されています。
細胞の足場となる細胞外マトリックスの分子組成は胚発生の進行とともに多様化していきます。基底膜のラミニンも胚発生の進行に伴ってα5鎖を含むラミニン511から他のα鎖を含むタイプに置き換わります。私たちは、足場となるラミニンを細胞ごとにカスタマイズすることにより、効率よくヒトiPS細胞から目的の細胞を分化誘導できることを見いだしています。肝臓細胞を誘導するときはラミニン111の活性断片(ラミニン111E8断片)が有効でありref.11、血管内皮細胞を誘導するときはラミニン411の活性断片(ラミニン411E8断片)が有効ですref.12。神経細胞や網膜色素上皮細胞はラミニン511E8断片上で効率よく誘導することができますref.13。
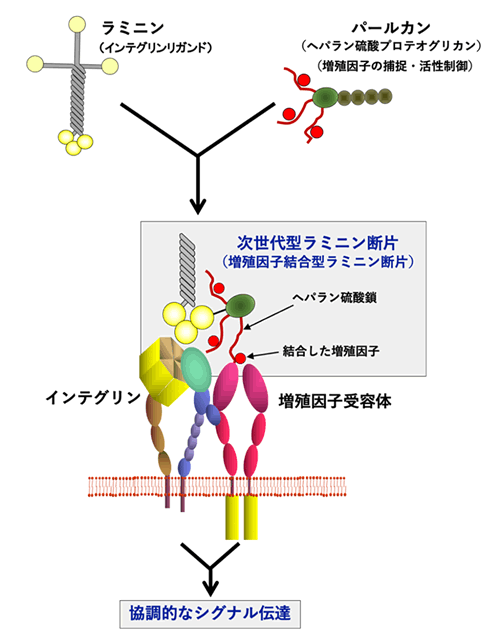
その一方で、ラミニンのタイプを最適化するだけで基底膜の足場活性の全部を再現できるわけではありません。基底膜には、インテグリンと結合するラミニンの他に、パールカンに代表されるヘパラン硫酸鎖を持つタンパク質(ヘパラン硫酸プロテオグリカン)が存在し、これがさまざまな増殖因子をヘパラン硫酸鎖で捕捉することにより、増殖因子の活性と局在を制御しています。私たちは、ラミニンの活性断片にパールカンのヘパラン硫酸鎖付加ドメインを連結したキメラタンパク質(次世代型ラミニン断片:上図)を作製し、これがヒトiPS細胞から骨格筋幹細胞や皮膚の真皮幹細胞を分化誘導するときの足場として非常に有効であることを見いだしていますref.15,16。また、このキメラタンパク質に細胞が接着すると、ラミニン活性断片に結合したインテグリンと、パールカンのヘパラン硫酸鎖に捕捉された増殖因子の受容体(増殖因子受容体)が細胞膜上で隣接し、インテグリンからのシグナルと増殖因子受容体からのシグナルが協調的に細胞内に入力される基底膜本来の足場環境が創出されると考えられます。次世代型ラミニン断片は、パーキンソン病モデル動物に移植したiPS細胞由来ドパミン産生神経細胞の成熟促進効果があることも最近明らかとなっていますref.14。
リンパ管形成を制御する細胞外マトリックス分子Polydom/SVEP1の機能解明
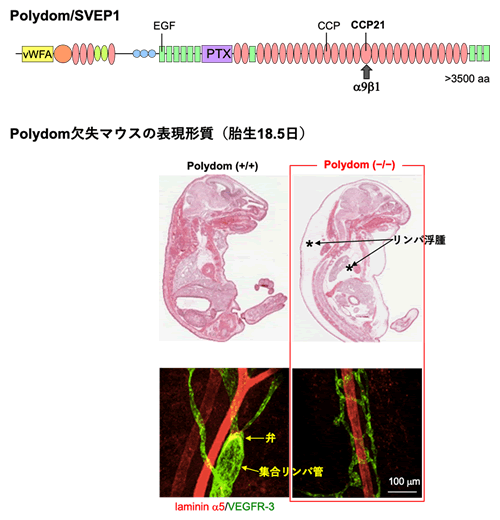
私たちはトランスクリプトーム情報を使って未知の細胞外マトリックスタンパク質を探索する過程で、α9β1インテグリンに結合する新規細胞外マトリックスタンパク質Polydom(別名SVEP1)を見いだしました(図上)ref.17。Polydomは胎児の間葉組織で主に発現しており、この遺伝子を欠失させたマウスは重度のリンパ浮腫を発症して、出生直後に死亡します(図中)ref.18。このPolydom欠失マウス胎児のリンパ管を経時的に解析すると、初期のリンパ管叢は形成されるものの、それに続く集合リンパ管やリンパ弁の形成が起こらないことがわかり、Polydomがリンパ管形成、特にリンパ管のリモデリング、に必要であることがわかりました(図下)ref.18。リンパ管のリモデリングには、Tie1と呼ばれるチロシンキナーゼドメインをもつ膜受容体やAngiopoietin-2と呼ばれる分泌タンパク質が関わることが知られています。私たちはPolydomがTie1と直接結合し、PI3K/Akt経路を介してリンパ管内皮細胞の遊走を誘導することを最近見いだしましたref.19。Tie1と結合するリガンド分子は長い間不明でしたが、その実体がPolydomであることが私たちの研究から明らかとなりました。
Polydomは間葉細胞が分泌するタンパク質で、脂肪組織で高い発現が認められています。私たちはマウス脂肪組織から分離した脂肪幹細胞がPolydomを高発現していることを見いだしています。脂肪幹細胞が発現(分泌)するPolydomが脂肪組織でどのような機能を担っているのか、現在、Polydom欠失マウスを使って解析を進めています。