- 機能・構造解析
- 技術開発1
- 技術開発2
1.セマフォリンシグナル伝達に関する研究
セマフォリンは、神経回路の形成、骨代謝、血管形成、がんの進展、免疫など、様々な生理活性に寄与する分子群です。セマフォリンの主要な受容体としては、プレキシンやニューロピリンが知られており、各セマフォリン分子は、それぞれに対応する受容体に特異的に結合することでシグナルを伝達し、機能を発現します。本研究室では、セマフォリンがどのようにして受容体を活性化し、シグナルを伝達するのかを解明することを目指しています。
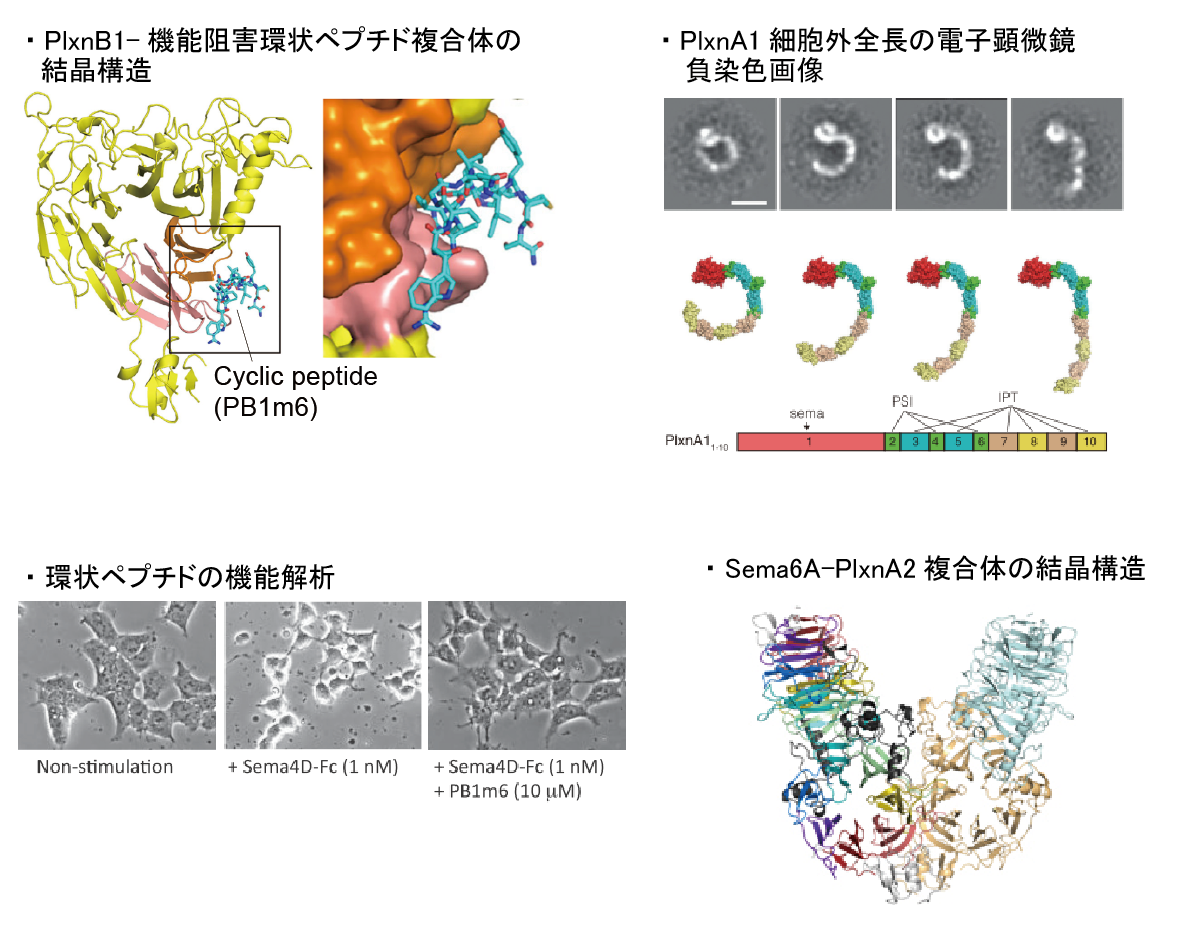
【関連文献】
[Matsunaga Y, et al. (2016) Cell Chem. Biol.]
[Suzuki K, et al. (2016) PLoS One]
[Nogi T, et al. (2010) Nature]
2.Wntシグナル伝達経路に関する研究
Wntシグナル伝達経路は、細胞増殖、発生、分化、細胞死など様々な細胞応答を制御しています。分泌性リガンドであるWntは、ヒトでは19種類同定されており、これらは受容体である7回膜貫通型蛋白質Frizzledへ結合することでこのシグナル経路を活性化します。また、Wntシグナル伝達経路には、βカテニンを介して遺伝子の発現を制御する「古典的経路」と、βカテニンを介さない「非古典的経路」が存在し、古典的経路では更に共役受容体としてLRP5/6といった一回膜貫通蛋白質も必要なことが明らかとなっています。私たちはこれらのシグナル経路に関わる分子の構造-機能相関を明らかにすることを大きな目標としています。そのためには標的分子の単離が必要ですが、これまではWnt特有の「水に溶けない」性質が精製Wnt蛋白質の取得を困難なものにしてきました。最近、私たちはこの「水に溶けない」問題を解決することに成功し、さらに、世界で初めてほ乳類由来Wnt-Frizzled複合体の立体構造を明らかにすることにも成功しています。
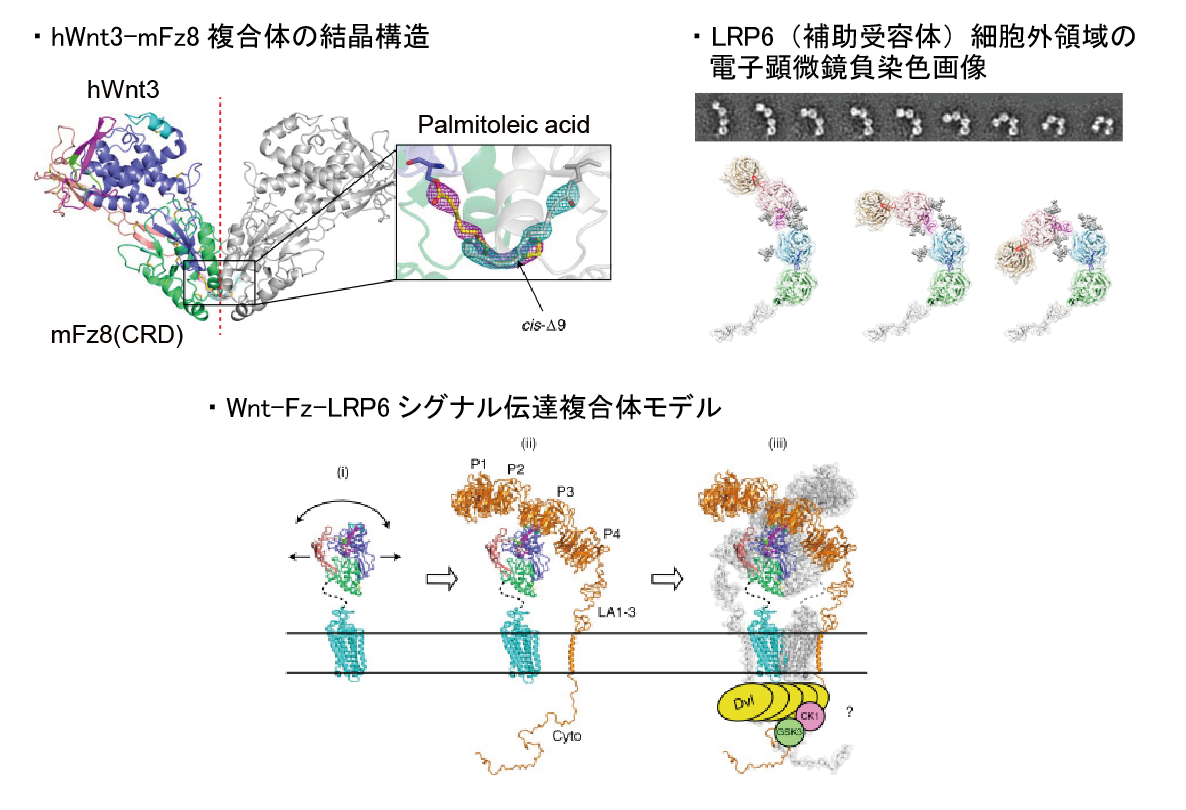
【関連文献】
[Hirai H, et al. (2019) Nature Struct. Mol. Biol.]
[Matoba K, et al. (2017) Cell Reports]
[Mihara E, et al. (2016) eLife]
3.細胞接着分子インテグリンの研究
インテグリンは細胞が細胞外マトリックス(ECM)や他の細胞に接着する際にその仲立ちをする受容体です。ヒトでは24種類以上のインテグリンが知られており、そのそれぞれが違った相手(リガンド分子)と結合します。インテグリンを介した細胞接着は多細胞動物の生命活動に必須であり、その異常は自己免疫疾患、血栓症、癌など様々な疾患の原因となります。本研究室では、ヒトにおけるインテグリンの生理機能を徹底的に明らかにするため、高品質組み換えインテグリンをずらりとそろえ、その構造解析とリガンド認識特異性の原子レベルでの理解を目指しています。
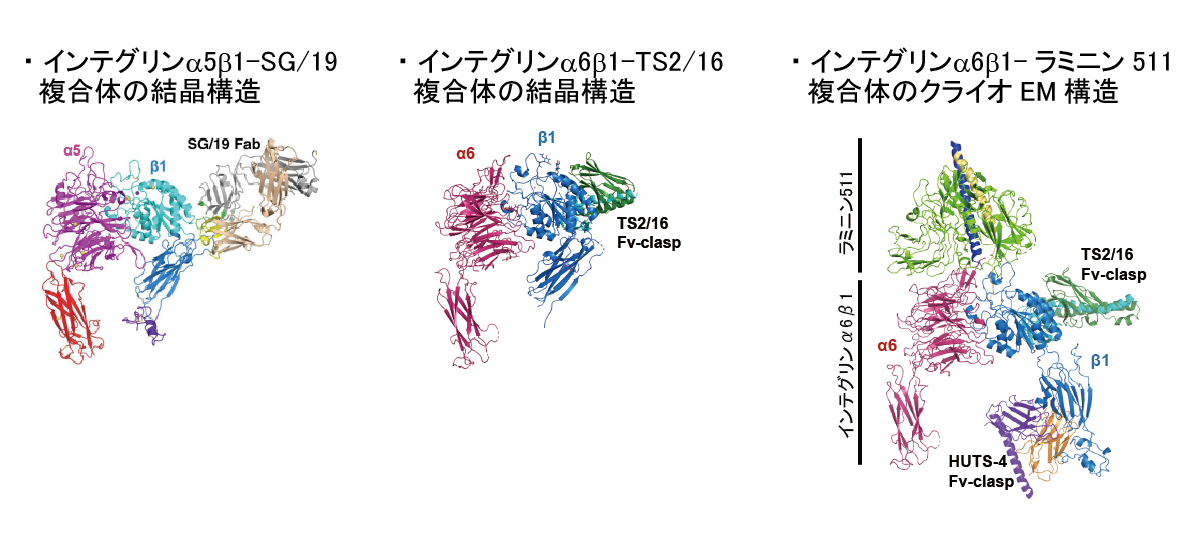
【関連文献】
[Arimori T, et al. (2021) Nature Communications]
[Nagae M. et al. (2012) J. Cell Biol.]
4.がん進展に関わる受容体とそのリガンドである増殖因子の研究
肝細胞増殖因子である HGFは、その受容体であるMetを介して細胞内にシグナルを伝達し、器官形成や組織の再生を促す生理活性物質です。このシグナルを促進する因子は肝疾患などの治療薬となり得ますが、一方で、がん原遺伝子産物であるMetは、その異常な活性化によりがんの進展をもたらすことが知られており、抗がん剤の標的分子としても注目されています。しかし、HGFがMetに結合してMetを活性化させるまでの分子機構は非常に複雑であり、まだ多くのことがわかっていません。わたしたちは、構造生物学的アプローチにより、HGFによるMetを介したシグナル伝達機構の全容を解明することを目指しています。
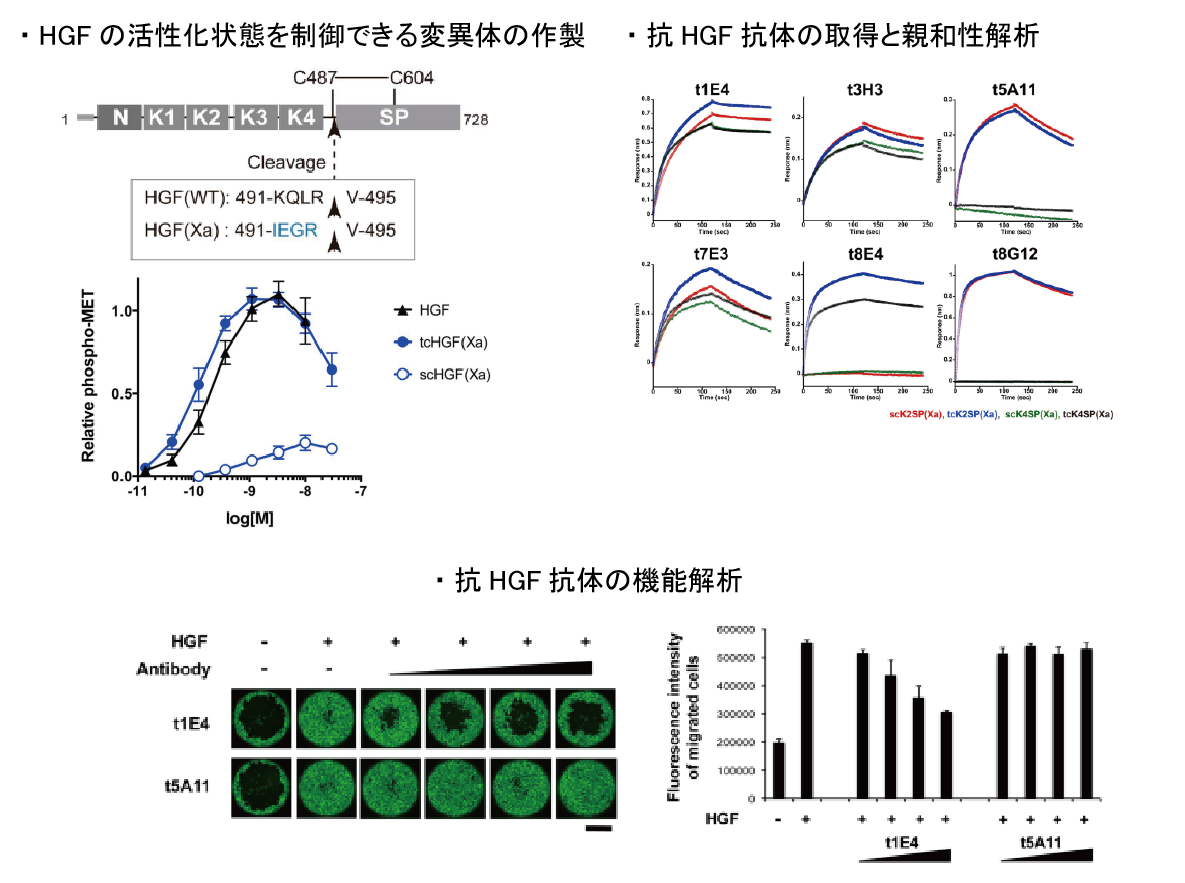
【関連文献】
[Umitsu M, et al. (2020) J Biochem.]
[Umitsu M, et al. (2016) Sci. Rep.]
1.環状ペプチドgrafting技術の開発と応用
東京大学の菅裕明教授が開発したRaPIDシステムは、1012にもおよぶ膨大なスケールの特殊環状ペプチドライブラリーを用いることで、標的分子に対して特異的かつ高親和性で結合する特殊環状ペプチド(10数残基で構成)を創出することができます。私たちは菅グループとの共同研究により、タンパク質のループ領域にこの環状ペプチドを組み込む技術であるLassoGraft Technology®を開発しました。この技術により、抗体のFc領域やアルブミンなどの様々なタンパク質を、受容体などの様々な標的分子に結合できるように改変することができます。私たちはこの技術を応用し、新しい抗体様分子の創製や、アデノ随伴ウイルス(AAV)を利用して高効率に細胞へ遺伝子を導入する技術の開発などを行っています。
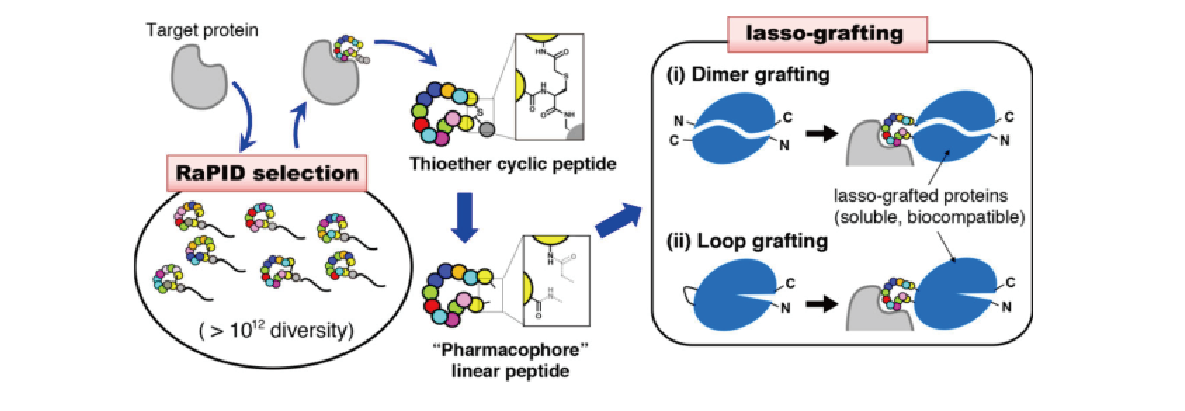
【関連文献】
[Mihara E, et al. (2021) Nature Communications]
抗体様バインダー“Mirabody®”
環状ペプチド配列は、あらゆるタンパク質のループ領域に挿入可能であることを私たちは実証していますが、中でも抗体のFc領域は、構造的に安定なホモ二量体分子であり、ペプチド挿入の土台タンパク質として非常に有用です。1分子のFcの中には8ヵ所のペプチド挿入が可能なループがあり(S1-S8)、これらのうち1か所に環状ペプチド配列を挿入すると、2価のバインダータンパク質が得られます。また、異なる環状ペプチド配列を2ヵ所、あるいはそれ以上のループに挿入することで、多重特異性抗体のような分子を容易に創成することができます。このようにFcに環状ペプチドの配列を挿入したものを我々は”Mirabody®”と名付けました。
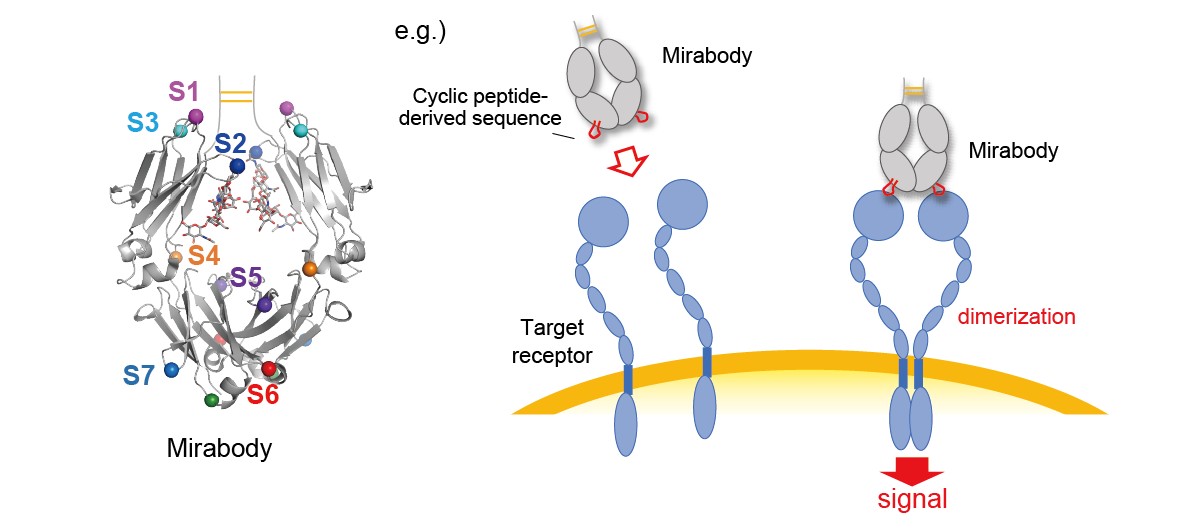
【関連文献】
[Sugano-Nakamura N, et al. (2022) Structure]
[Skai K, et al. (2022) Nat. Biomed. Eng.]
AAVを応用した標的細胞への選択的遺伝子導入
近年、アデノ随伴ウイルスは、非病原性や免疫原性の低さ、遺伝子発現の持続性などといった特長から、遺伝子治療のベクターとして注目を集めています。しかし、アデノ随伴ウイルスは非特異的に幅広い組織や臓器に感染することが問題とされています。そこで、当研究室では、組織や臓器特異的に発現している受容体に結合するRaPID ペプチドを、アデノ随伴ウイルスの外殻タンパクのループ部分に挿入することで,ターゲット特異性の高いアデノ随伴ウイルスベクターの開発を行っています。
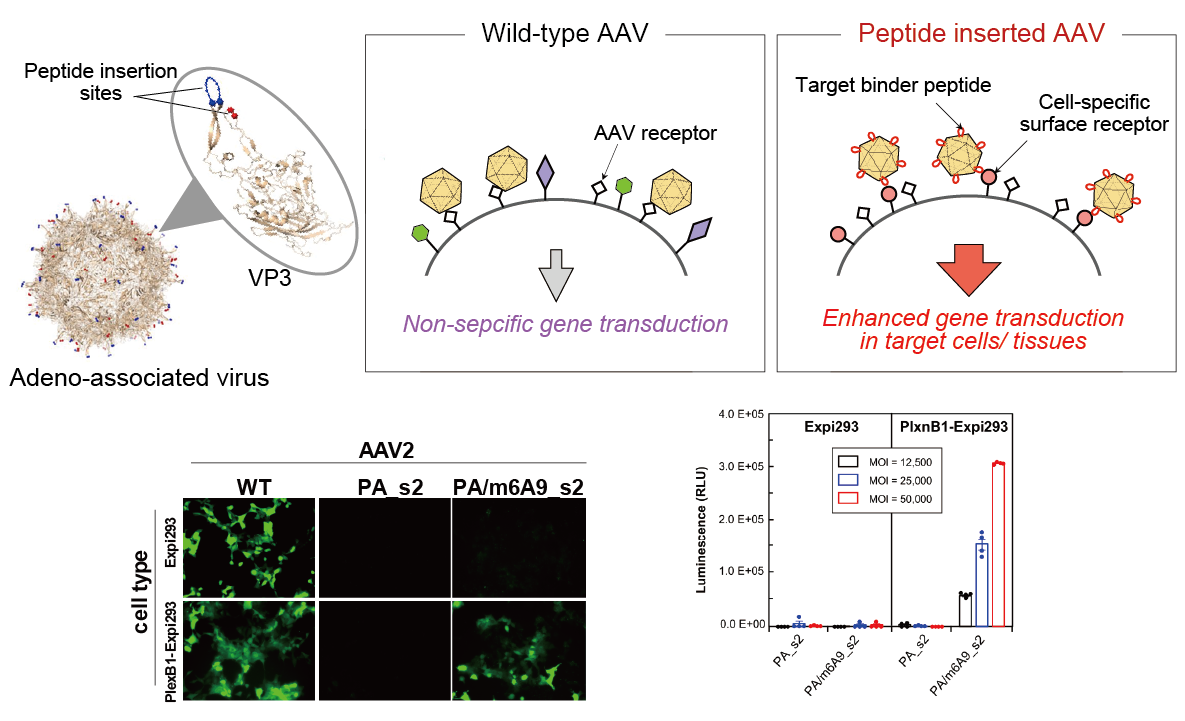
2. 小型抗体フォーマット"Fv-clasp"
タンパク質の結晶化実験においては、結晶化を促進させる「結晶化シャペロン」として、抗体を断片化した小型抗体が利用されています。これは、小型抗体を標的分子に結合させることで、構造が均一になったり、分子の会合が促進されたりするためです。また、クライオ電子顕微鏡による単粒子解析では、構造の安定化、観察対象のサイズの増大、画像アラインメントの際のマーカーとしての利用などを目的に小型抗体が使われています。私たちは、抗体のFv領域に逆平行のコイルドコイルを形成するSARAHドメインを融合した,全く新しい小型抗体フォーマット「Fv-clasp」を開発しました。様々な解析の結果、Fv-claspは従来の小型抗体(Fabやsingle-chain Fv)よりあらゆる面で優れた性質を有していることが明らかになりました。現在、このFv-claspを応用した様々な研究を進めています。
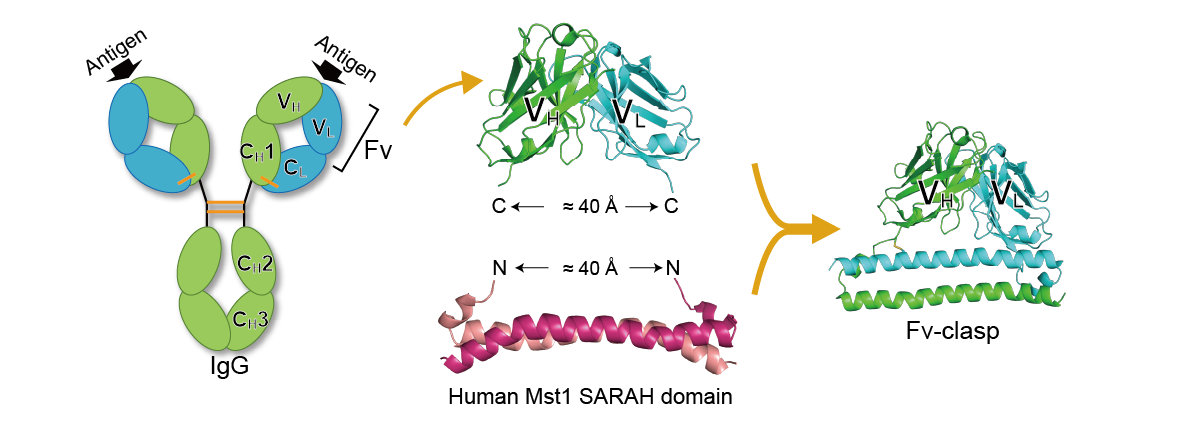
Fv-claspの特長
・大腸菌発現系を利用して生産可能
・どんな抗体にも適用可能
・高い抗原結合活性を保持
・熱安定性が高い
・極めて結晶になりやすい
【関連文献】
[Arimori T, et al. (2017) Structure]
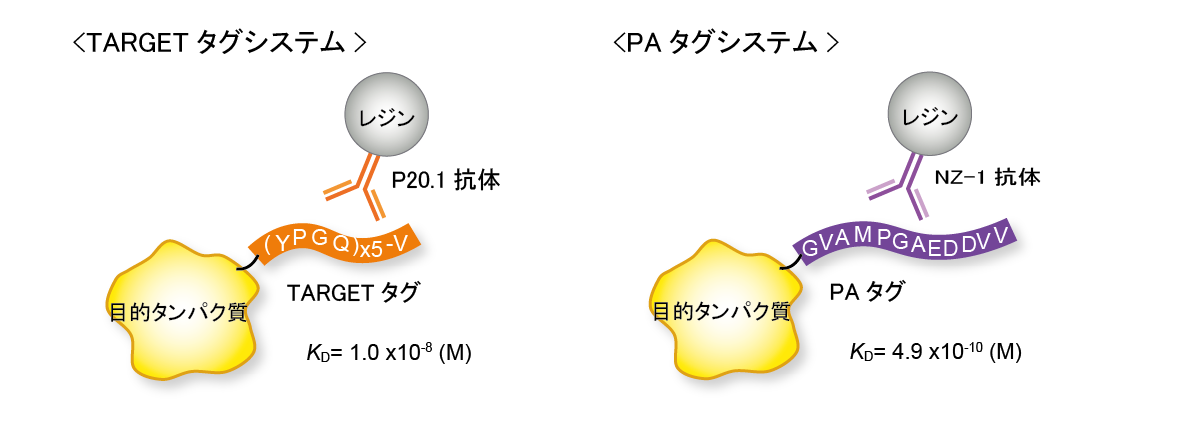
3. 独自のアフィニティー精製タグの開発
動物細胞発現系で得られる組み換え蛋白質は微量で、効率の良いアフィニティー精製タグが求められます。しかし 市販のシステムではコストと時間がかかりすぎる欠点がありました。我々は独自に開発したペプチドタグに対する モノクローナル抗体を使って、極めて迅速に、高品質蛋白質を精製すること成功しています。また、抗体の立体構造をもとにタグシステムのデザインの最適化や新たな応用法の開発なども行っています。
TARGETタグシステム,PAタグシステム
・独自のアフィニティータグシステム
・ワンステップでの高純度タンパク質精製が可能
・競合ペプチドやマイルドな溶液条件で溶出が可能
・レジンの繰り返し利用が可能
【関連文献】
[Nogi T, et al. (2008) Protein Sci.]
[Fujii Y, et al. (2014) Protein Expr. Purif.]
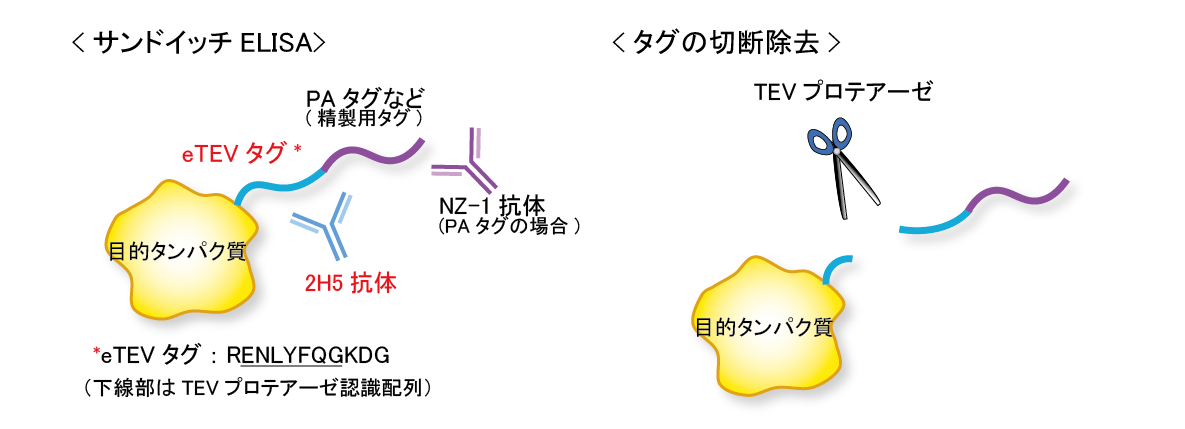
W-tagシステム
私たちが開発したeTEVタグシステムは、TEVプロテアーゼ認識配列を含むエピトープタグ(eTEVタグ)と、その特異抗体2H5を利用したタグシステムです。このeTEVタグは、PAタグなどの精製用のタグとタンデムに繋げて利用しており、このタグシステムを特にW-tagシステムと呼んでいます。W-tagシステムを用いれば,標的分子に対する特異抗体を持っていなくても、タグ配列を認識する2種類の抗体(2H5(抗eTEVタグ抗体)とNZ-1(抗PAタグ抗体)など)を利用したサンドウィッチELISAにより、高感度に標的分子を検出することができます。さらに、タグ配列部分は、eTEVタグ中のTEVプロテアーゼ認識配列を利用して切断することができます。
【関連文献】
[Tabata S, et al. (2018) Protein Expr. Purif.]
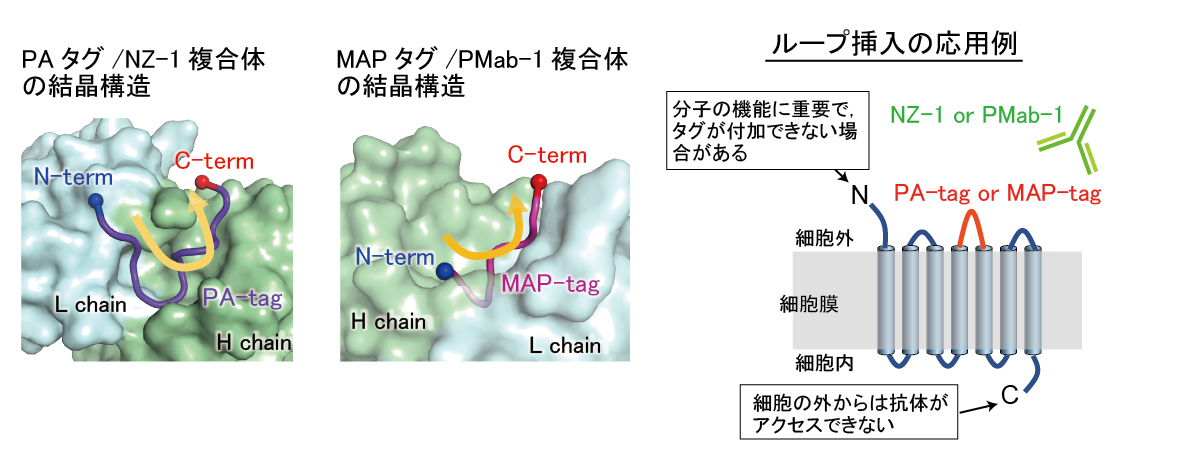
タンパク質のループ領域に挿入可能なタグ
PAタグとMAPタグは、どちらもU字型コンフォメーションでそれぞれの特異抗体(NZ-1およびPMab-1)に結合し、タグの両末端は溶媒側に露出していることを結晶構造から明らかにしました。このような特徴から、PAタグおよびMAPタグは標的タンパク質の立体構造を崩すことなく、タンパク質のループ領域に挿入して利用することができます。ループに挿入したこれらのタグと対応する抗体を用いれば、末端にタグを付加した場合と同様に、標的タンパク質の精製や検出が可能です。
【関連文献】
[Fujii Y, et al. (2016) J. Cell Science]
[Wakasa A, et al. (2020) J. Biochem]
