業績集
Achievements
論文一覧
Authors
Title
Journal
Koki Kobayashi, Taro Chaya, Hung-Ya Tu, Yamato Maeda, Yuki Nakashima, Ryotaro Tsutsumi, Haruka Yamamoto, Toshinori Tsujii, Daisuke Okuzaki and Takahisa Furukawa
Dysfunction of Unc119, a transducin-binding protein, leads to cone-rod dystrophy through activating JAK-STAT and NF-κB inflammatory pathways in the mouse retina
Journal of Neuroscience
https://doi.org/10.1523/JNEUROSCI.2245-24.(2025)
https://www.jneurosci.org/content/early/2025/10/16/JNEUROSCI.2245-24.2025
Yuko Sugita, Koki Kobayashi, Hung-Ya Tu, Daisuke Okuzaki, Takahisa Furukawa
Blackcurrant anthocyanins improve visual contrast resolution for optokinetic responses in aging mice
Neuroscience
https://doi.org/10.1016/j.neuroscience.2025.09.003(2025)
https://www.sciencedirect.com/science/article/pii/S0306452225009170
Kazuki Fujieda, Hitoshi Sumihiro, Rika Saito, Koki Kobayashi, Yuki Miyanohara, Shinya Abe, Toshinori Tsujii, Hung-Ya Tu, Takahisa Furukawa
Id2 transcriptional repressor promotes retinal Müller glial cell fate choice by increasing Notch activity
Biochemical and Biophysical Research Communications
https://doi.org/10.1016/j.bbrc.2025.151966(2025)
https://www.sciencedirect.com/science/article/pii/S0006291X25006801?via%3Dihub
Taro Chaya, Yamato Maeda, Ryotaro Tsutsumi, Makoto Ando, Yujie Ma, Naoko Kajimura, Teruyuki Tanaka, Takahisa Furukawa
Ccrk-Mak/Ick signaling is a ciliary transport regulator essential for retinal photoreceptor survival
Life Science Alliance
https://doi.org/10.26508%2Flsa.202402880 (2024)
https://www.life-science-alliance.org/content/7/11/e202402880
Leah Rie Varner, Taro Chaya, Yamato Maeda, Ryotaro Tsutsumi, Shanshan Zhou, Toshinori Tsujii, Daisuke Okuzaki, Takahisa Furukawa
The deubiquitinase Otud7b suppresses cone photoreceptor degeneration in mouse models of retinal degenerative diseases
iScience
https://doi.org/10.1016/j.isci.2024.109380 (2024)
https://www.cell.com/iscience/fulltext/S2589-0042(24)00601-1
Takuya Yoshimoto, Taro Chaya, Leah R. Varner, Makoto Ando, Toshinori Tsujii, Daisuke Motooka, Kazuhiro Kimura, Takahisa Furukawa The Rax homeoprotein in Müller glial cells is required for homeostasis maintenance of the postnatal mouse retina
Journal of Biological Chemistry
https://doi.org/10.1016%2Fj.jbc.2023.105461 (2023)
https://www.jbc.org/article/S0021-9258(23)02489-4/fulltext
Taro Chaya, Yamato Maeda, Ryo Sugimura, Haruka Yamamoto, Hidemasa Kato, Takahisa Furukawa
Multiple knockout mouse and embryonic stem cell models reveal the role of miR-124a in neuronal maturation
Journal of Biological Chemistry
https://doi.org/10.1016%2Fj.jbc.2022.102293 (2022)
https://www.jbc.org/article/S0021-9258(22)00735-9/fulltext
Ryotaro Tsutsumi, Taro Chaya, Toshinori Tsujii, Takahisa Furukawa
The carboxyl-terminal region of SDCCAG8 comprises a functional module essential for cilia formation as well as organ development and homeostasis
Journal of Biological Chemistry
https://doi.org/10.1016/j.jbc.2022.101686 (2022)
https://www.jbc.org/article/S0021-9258(22)00126-0/fulltext
Taro Chaya, Hiroshi Ishikane, Leah R Varner, Yuko Sugita, Yamato Maeda, Ryotaro Tsutsumi, Daisuke Motooka, Daisuke Okuzaki, Takahisa Furukawa
Deficiency of the neurodevelopmental disorder-associated gene Cyfip2 alters the retinal ganglion cell properties and visual acuity
HUMAN MOLECULAR GENETICS
https://doi.org/10.1093/hmg/ddab268
https://academic.oup.com/hmg/advance-article/doi/10.1093/hmg/ddab268/6368510
Daichi Gyoten, Shinji Ueno, Satoshi Okado, Taro Chaya, Shunsuke Yasuda, Takeshi Morimoto, Mineo Kondo, Kazuhiro Kimura, Takaaki Hayashi, Bart P Leroy, Se Joon Woo, Ryo Mukai, Kwangsic Joo, Takahisa Furukawa
Broad locations of antigenic regions for anti-TRPM1 autoantibodies in paraneoplastic retinopathy with retinal ON bipolar cell dysfunction
Experimantal Eye Research
https://doi.org/10.1016/j.exer.2021.108770
https://www.sciencedirect.com/science/article/abs/pii/S0014483521003365?via%3Dihub
Shun Kubo, Haruka Yamamoto, Naoko Kajimura, Yoshihiro Omori, Yamato Maeda, Taro Chaya, Takahisa Furukawa
Functional analysis of Samd11, a retinal photoreceptor PRC1 component, in establishing rod photoreceptor identity
Scientific Reports
https://doi.org/10.1038/s41598-021-83781-1
https://www.nature.com/articles/s41598-021-83781-1
Takefumi Sugiyama, Haruka Yamamoto, Tetsuo Kon, Taro Chaya, Yoshihiro Omori, Yutaka Suzuki, Kentaro Abe, Dai Watanabe, Takahisa Furukawa
The potential role of Arhgef33 RhoGEF in foveal development in the zebra finch retina
Scientific Reports
https://doi.org/10.1038/s41598-020-78452-6
https://www.nature.com/articles/s41598-020-78452-6
Yuko Sugita, Haruka Yamamoto, Yamato Maeda, Takahisa Furukawa
Inluence of aging on the retina and visual motion processing for optokineic responses in mice
Frontiers in Neuroscience
https://doi.org/10.3389/fnins.2020.586013
https://www.frontiersin.org/articles/10.3389/fnins.2020.586013/full
Tetsuo Kon, Takahisa Furukawa
Origin and evolution of the Rax homeobox gene by comprehensive evolutionary analysis
FEBS open bio
https://doi.org/10.1002/2211-5463.12832
https://febs.onlinelibrary.wiley.com/doi/full/10.1002/2211-5463.12832
Yuko Sugita, Kenichiro Miura, Takahisa Furukawa
Retinal ON and OFF pathways contribute to initial optokinetic responses with different temporal characteristics
European Journal of Neuroscience
https://doi.org/10.1111/ejn.14697
https://onlinelibrary.wiley.com/doi/full/10.1111/ejn.14697?af=R
Haruka Yamamoto, Tetsuo Kon, Yoshihiro Omori, Takahisa Furukawa
Functional and Evolutionary Diversification of Otx2 and Crx in Vertebrate Retinal Photoreceptor and Bipolar Cell Development
Cell Reports
https://doi.org/10.1016/j.celrep.2019.212.072
https://www.cell.com/cell-reports/fulltext/S2211-1247(19)31729-2
Taro Chaya, Ryotaro Tsutsumi, Leah Rie Varner, Yamato Maeda, Satoyo Yoshida, Takahisa Furukawa
Cul3‐Klhl18 ubiquitin ligase modulates rod transducin translocation during light‐dark adaptation
EMBO J.
https://doi.org/10.15252/embj.2018101409
https://www.embopress.org/doi/10.15252/embj.2018101409
Takashi Kozuka, Yoshihiro Omori, Satoshi Watanabe, Etsuko Tarusawa, Haruka Yamamoto, Taro Chaya, Mayu Furuhashi, Makiko Morita, Tetsuya Sato, Shinichi Hirose, Yasuyuki Ohkawa, Yumiko Yoshimura, Takatoshi Hikida & Takahisa Furukawa
miR-124 dosage regulates prefrontal cortex function by dopaminergic modulation
Scientific Reports
https://doi.org/10.1038/s41598-019-38910-2
https://www.nature.com/articles/s41598-019-38910-2
Ryotaro Tsutsumi, Taro Chaya, Takahisa Furukawa
Enriched expression of the ciliopathy gene Ick in cell proliferating regions of adult mice
Gene Expression Patterns
doi:10.1016/j.gep.2018.04.005
https://www.sciencedirect.com/science/article/pii/S1567133X18300140
Akiko Ueno, Yoshihiro Omori, Yuko Sugita, Satoshi Watanabe, Taro Chaya, Takashi Kozuka, Tetsuo Kon, Satoyo Yoshida, Kenji Matsushita, Ryusuke Kuwahara, Naoko Kajimura, Yasushi Okada, Takahisa Furukawa
Lrit1, a Retinal Transmembrane Protein, Regulates Selective Synapse Formation in Cone Photoreceptor Cells and Visual Acuity
Cell Reports 22, 3548–3561 March 27, 2018
doi:10.1016/j.celrep.2018.03.007
http://www.cell.com/cell-reports/fulltext/S2211-1247(18)30321-8
Michio Miyajima, Baihao Zhang, Yuki Sugiura, Kazuhiro Sonomura, Matteo M Guerrini, Yumi Tsutsui, Mikako Maruya, Alexis Vogelzang, Kenji Chamoto, Kurara Honda, Takatoshi Hikida, Satomi Ito, Hongyan Qin, Rikako Sanuki, Keiichiro Suzuki, Takahisa Furukawa, Yasushi Ishihama, Fumihiko Matsuda, Makoto Suematsu, Tasuku Honjo and Sidonia Fagarasan
Metabolic shift induced by systemic activation of T cells in PD-1-deficient mice perturbs brain monoamines and emotional behavior
Nature Immunology.
doi:10.1038/ni.3867
https://www.nature.com/articles/ni.3867
Kozuka T, Chaya T, Tamalu F, Shimada M, Fujimaki-Aoba K, Kuwahara R, Watanabe SI, Furukawa T.
The TRPM1 channel is required for development of the rod ON bipolar cell-AII amacrine cell pathway in the retinal circuit.
J Neurosci. 2017 Sep 12.
pii: 0824-17. http://www.jneurosci.org/content/early/2017/09/12/JNEUROSCI.0824-17.2017
Omori Y, Kubo S, Kon T, Furuhashi M, Narita H, Kominami T, Ueno A, Tsutsumi R, Chaya T, Yamamoto H, Suetake I, Ueno S, Koseki H, Nakagawa A and Furukawa T
Samd7 is a cell type-specific PRC1 component essential for establishing retinal rod photoreceptor identity.
Proc Natl Acad Sci U S A. 2017. 論文解説⑥
Taro Chaya, Akihiro Matsumoto, Yuko Sugita, Satoshi Watanabe, Ryusuke Kuwahara, Masao Tachibana and Takahisa Furukawa
Versatile functional roles of horizontal cells in the retinal circuit.
Sci Rep. 2017 Jul 17;7(1):5540. 論文解説⑤
Okamoto S, Chaya T, Omori Y, Kuwahara R, Kubo S, Sakaguchi H and Furukawa T
Ick ciliary kinase is essential for planar cell polarity formation in inner ear hair cells and hearing function
J. of Neurosci, 2017, Feb 22;37(8): 2073-2085. 論文解説④
Irie S, Sanuki R, Muranishi Y, Kato K, Chaya T, Furukawa T
Rax Homeoprotein Regulates Photoreceptor Cell Maturation and Survival in Association with Crx in the Postnatal Mouse Retina.
Mol Cell Biol 35:2583–2596.
doi:10.1128/MCB.00048-15.
Omori Y, Chaya T, Yoshida S, Irie S, Tsujii T, Furukawa T.
Identification of G Protein-Coupled Receptors (GPCRs) in Primary Cilia and Their Possible Involvement in Body Weight Control.
PLoS One. 2015 Jun 8;10(6):e0128422.
doi: 10.1371/journal.pone.0128422. eCollection 2015.
Watanabe S, Sanuki R, Sugita Y, imai W, Yamazaki R, Kozuka T, Ohsuga M, Furukawa T.
Prdm13 Regulates Subtype Specification of Retinal Amacrine Interneurons and Modulates Visual Sensitivity.
J. of Neurosci, 2015, May 20;35(20): 8004-20. 論文解説①
Chaya T, Omori Y, Kuwahara R, Furukawa T.
ICK is essential for cell type-specific ciliogenesis and the regulation of ciliary transport.
EMBO J. 2014,
doi:10.1002/embj.201488175
Alves CH, Pellissier LP, Vos RM, Garcia Garrido M, Sothilingam V, Seide C, Beck SC, Klooster J, Furukawa T, Flannery JG, Verhaagen J, Seeliger MW & Wijnholds J
Targeted ablation of Crb2 in Photoreceptor Cells induces Retinitis Pigmentosa.
Hum Mol Genet. 2014,
doi:10.1093/hmg/ddu048
Mizuhashi K, Kanamoto T, Moriishi T, Muranishi Y, Miyazaki T, Terada K, Omori Y, Ito M, Komori T, Furukawa T
Filamin-interacting proteins, Cfm1 and Cfm2, are essential for the formation of cartilaginous skeletal elements.
Hum Mol Genet. 2014,
doi:10.1093/hmg/ddu007
Iida A, Iwagawa T, Kuribayashi H, Satoh S, Mochizuki Y, Baba Y, Nakauchi H, Furukawa T, Koseki H, Murakami A & Watanabe S
Histone demethylase Jmjd3 is required for the development of subsets of retinal bipolar cells.
Proc Natl Acad Sci USA, 2014,111(10): 3751-3756.
Kanda A, Noda K, Yuki K, Ozawa Y, Furukawa T, Ichihara A & Ishida S
Atp6ap2/(Pro)renin receptor interacts with Par3 as a cell polarity determinant required for laminar formation during retinal development in mice.
J. of Neurosci, 2013, 33(49): 19341-19351.
Yamazaki D, Funato Y, Miura J, Sato S, Toyosawa S, Furutani K, Kurachi Y, Omori Y, Furukawa T, Tsuda T, Kuwabata S, Mizukami S,Kikuchi K & Miki H
Basolateral Mg2+ Extrusion via CNNM4 Mediates, Transcellular Mg2+, Transport across Epithelia: A Mouse Model.
PLOS Gene. 2013, 9(12): e1003983.
Sugita Y, Miura K, Araki F, Furukawa T, Kawano & K.Eur
Contributions of retinal direction-selective ganglion cells to optokinetic responses in mice.
Eur J Neurosci. 2013, 38(6): 2823-31.
Eberhart A, Feodorava Y, Song C, Wanner G, Kiseleva E, Hake S, Furukawa T, Kimura H, Schotta G, Leonhardt H, Joffe B & Solovei I
Epigenetics of eu- and heterochromatin in inverted and conventional nuclei.
Chromosome Res. 2013, 20(5): 535-554.
Watanabe S, Sanuki R, Ueno S, Koyasu T, Hasegawa T, Furukawa T
Tropisms of AAV for subretinal delivery to the neonatal mouse retina and its application for in vivo rescue of developmental photoreceptor disorders.
PLoS One. 2013; 8(1):e54146.
Katoh K, Yamazaki R, Onishi A, Sanuki R, Furukawa T.
G9a histone methyltransferase activity in retinal progenitors is essential for proper differentiation and survival of mouse retinal cells.
J. of Neurosci. 2012, Dec 5;32(49):17658-70.
Muranishi Y & Furukawa T
BAC-Dkk3-EGFP Transgenic Mouse: An In Vivo Analytical Tool for Dkk3 Expression.
J Biomed Biotechnol. 2012:973140.
Peachey NS, Pearring JN, Bojang P, Jr., Hirschtritt ME, Sturgill-Short G, Ray TA, Furukawa T, Koike C, Goldberg AF, Shen Y, McCall MA, Nawy S, Nishina PM, & Gregg RG
Depolarizing Bipolar Cell Dysfunction due to a Trpm1 Point Mutation.
J Neurophysiol. 2012, 108(9):2442-2451.
Ochocinska MJ, Muñoz EM, Veleri S, Weller JL, Coon SL, Pozdeyev N, Michael Iuvone P, Goebbels S, Furukawa T & Klein DC
NeuroD1 is required for survival of photoreceptors but not pinealocytes: Results from targeted gene deletion studies.
J Neurochem. 2012, 123(1):44-59.
Omori Y, Araki F, Chaya T, Kajimura N, Irie S, Terada K, Muranishi Y, Tsujii T, Ueno S, Koyasu T, Tamaki Y, Kondo M, Amano S, Furukawa T.
Presynaptic Dystroglycan-Pikachurin Complex Regulates the Proper Synaptic Connection between Retinal Photoreceptor and Bipolar Cells.
J. of Neurosci. 2012 May 2;32(18): 6126-6137.
Muranishi Y, Terada K, Inoue T, Katoh K, Tsujii T, Sanuki R, Kurokawa D, Aizawa S, Tamaki Y, Furukawa T.
An Essential Role for RAX Homeoprotein and NOTCH–HES Signaling in Otx2 Expression in Embryonic Retinal Photoreceptor Cell Fate Determination.
J. of Neurosci. 2011, 31(46): 16792-16807
Sanuki, R., Onishi, A., Koike C., Muramatsu R., Watanabe S., Muranishi Y., Irie S., Uneo S., Koyasu T., Matsui R., Chérasse Y., Urade Y., Watanabe D., Kondo M., Yamashita T. & Furukawa T.
miR-124a is required for hippocampal axogenesis and retinal cone survival through Lhx2 suppression, Nature Neuroscience, 14, 1125–1134 (2011)
Pearring, J., Bojang Jr., P., Shen, Y., Koike, C., Furukawa, T., Nawy, S. & Gregg, R.
A Role for Nyctalopin, a Small Leucine-Rich Repeat Protein, in Localizing the TRP Melastatin 1 Channel to Retinal Depolarizing Bipolar Cell Dendrites.
J. of Neurosci. 31(27), 10060-10066 (2011)
*Omori, Y., *Katoh, K., *Sato, S., Muranishi, Y., Chaya, T., Onishi, A., Minami, T., Fujikado, T., & Furukawa, T.
Analysis of transcriptional regulatory pathways of photoreceptor genes by expression profiling of the Otx2-deficient retina.
PLoS ONE, 6(5), e19685 (2011)
(*First three authors contributed equally to this work.)
*Kondo, M., *Sanuki, R., Ueno, S., Nishizawa, Y., Hashimoto, N., Ohguro, H., Yamamoto, S., Machida, S., Terasaki, H., Adamus, Grazyna., & Furukawa, T.,
Indentification of autoantibodies against TRPM1 in patients with paraneoplastic retinopathy associated with ON bipolar cell dysfunction.
PLoS ONE, 6(5), e19911 (2011)
(*These authors contributed equally to this work.)
Okada, I., Hamanoue, H., Terada, K., Tohma, T., Megarbane, A., Chouery, E., Abou Ghoch, J., Jalkh, N., Cogulu, O., Ozkinay, F., Horie, K., Takeda, J., Furuichi, T., Ikegawa, S., Nishiyama, K., Miyatake, S.,
Nishimura, A., Mizuguchi, T., Niikawa, N., Hirahara, F., Kaname, T., Yoshiura, K., Tsurusaki, Y., Doi, H., Miyake, N., Furukawa, T., Matsumoto, N. & Saitsu, H.
SMOC1 is essential for ocular and limb development in humans and mice.
Am. J. Hum. Genet.,88, 1-12 (2010)
Omori Y., Chaya T., Katoh K., Kajimura N., Sato S., Muraoka K., Ueno S., Koyasu T., Kondo M., & Furukawa T.
Negative regulation of ciliary length by ciliary male germ cell-associated kinase (Mak) is required for retinal photoreceptor survival.
Proc. Natl. Acad. Sci. USA, 2010 Dec. 8 論文解説②
Katoh, K., Omori Y., Onishi A., Sato S., Kondo M. & Furukawa, T. Blimp1 Suppresses Chx10 Expression in Differentiating Retinal Photoreceptor Precursors to Ensure Proper Photoreceptor Development.
J. of Neurosci, 30(19):6515-6526 (2010)
Nakamura, M., Sanuki, R., Yasuma, R, T., Onishi, A., Nishiguchi, M, K., Kadowaki, M., Kondo, M., Miyake, Y. & Furukawa, T.
TRPM1 mutations are associated with the complete form of congenital stationary night blindness.
Mol. Vision 16:425-437 (2010)
Katahira, T., Nakagiri, S., Terada, K. & Furukawa, T.
Secreted factor FAM3C (ILEI) is involved in retinal laminar formation.
BBRC, 392(3), 301-306 (2010)
Muranishi, Y., Sato, S., Inoue, T., Ueno, S., Koyasu, T., Kondo, M. & Furukawa, T.
Gene expression analysis of embryonic photoreceptor precursor cells using BAC-Crx-EGFP transgenic mouse.
BBRC, 392(3), 317-322 (2010)
Sanuki, R., Omori, Y., Koike, C., Sato, S. & Furukawa, T.
Panky, a novel photoreceptor-specific ankyrin repeat protein, is a transcriptional cofactor that suppresses CRX-regulated photoreceptor genes.
FEBS Letters, 584, 753-758 (2009)
Koike, C., Obara, T., Uriu, Y., Numata, T., Sanuki, R., Miyata, K., Koyasu, T., Ueno, S., Funabiki, K., Tani, A., Ueda, H., Kondo, M., Mori Y., Tachibana, M. & Furukawa, T.
TRPM1 is a component of the retinal ON bipolar cell transduction channel in the mGluR6 cascade.
Proc. Natl. Acad. Sci. USA, 2009 Dec.4. Epub ahead of print (2009)
Kanamoto, T., Mizuhashi, K., Terada, K., Minami, T., Yoshikawa, H. & Furukawa, T.
Isolation and characterization of a novel plasma membrane protein, osteoblast induction factor (obif), associated with osteoblast differentiation.
BMC Developmental Biology, 9:70 (2009)
Cao, Y., Masuho, I., Okawa, H., Xie, K., Asami, J., Kammermeier, P., Maddox, D., Furukawa, T., Inoue, T., Sampath, A. & Martemyanov, K.
Retina Specific GTPase Accelerator RGS11/Gβ5S/R9AP is a Constitutive Heterotrimer Selectively Targeted to mGluR6 in ON-Bipolar Neurons.
J. of Neurosci., 29, 9301-9313 (2009)
Sasaki, T., Watanabe, W., Muranishi, Y., Kanamoto, T., Aibara M., Miyazaki, K., Tamura, H., Saeki, T., Oda, H., Souchelnytskyi, N., Souchelnytskyi, S., Aoyama, H., Honda, Z., Furukawa, T., Mishima. K. H., Kiuchi, Y. & Honda, H.
Elevated Intraocular Pressure, Optic Nerve Atrophy, and Impaired Retinal Development in ODAG Transgenic Mice.
IOVS, 50, No.1, 242-248 (2009)
Sato, S., Omori, Y., Katoh, K., Kondo, M., Kanagawa, M., Miyata, K., Funabiki, K., Koyasu, T., Kajimura, N., Miyoshi, T., Sawai, H., Kobayashi K., Tani, A., Toda, T., Usukura, J., Tano, Y., Fujikado, T., Furukawa,T.
Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation.
Nat Neuroscience, 11, 923-931 (2008)
Omori, Y., Zhao, C., Saras, A., Mukhopadhyay, S., Kim, W., Furukawa, T., Sengupta, P., Veraksa, A., Malicki, J.
Elipsa is an early determinant of ciliogenesis that links the IFT particle to membrane-associated small GTPase Rab8.
Nat Cell Biol., 10, 434-444 (2008)
Koike, C., Nishida, A.,Ueno, S., Saito, H., Sanuki, R., Sato, S., Furukawa, A., Aizawa, S.,Matsuo, I., Suzuki, N., Kondo, M., Furukawa, T.
Functional roles of Otx2 transcription factor in postnatal mouse retinal development.
Mol. Cell Biol. 27, 8318-8329 (2007)
Sato, S., Inoue, T., Terada, K., Matsuo, I., Aizawa, S., Tano, Y., Fujikado, T., Furukawa, T.
Dkk3-Cre BAC trasngenic mouse line: A tool for hilghly efficient gene deletion in retinal progenitor cells.
Genesis, 45, 502-507 (2007)
Terada, K., Kitayama, A., Kanamoto, T., Ueno, N., Furukawa, T.
Nucleosome regulator Xhmgb3 is essential for progenitor cell proliferation of the eye and brain.
Developmental Biology, 291, 298-412 (2006)
Inoue, T., Terada, K., Furukawa, A., Koike, C., Tamaki, Y., Araie, M., Furukawa, T.
Cloning and characterization of mr-s, a novel SAM domain protein, predominantly expressed in retinal photoreceptor cells.
BMC Developmental Biology, 6:15 (2006)
Kanamoto, T., Terada, K., Yoshikawa, H., Furukawa, T.
Cloning and regulation of the vertebrate homologue of lin-41 which functions as heterochronic gene in Caenorhabditis elegans.
Developmental Dynamics, 235, 1142-1149 (2006)
Kanamoto, T., Terada, K., Yoshikawa, H., Furukawa, T.
Cloning and expression pattern of lbx3, a novel chick homeobox gene.
Mechanisms of Development/Gene Expression Patterns, 6. 241-246 (2006)
Koike, C., Nishida, A., Akimoto K., Nakaya, M., Noda, T., Ohno, S., Furukawa, T.
Function of aPKCl in differentiating photoreceptors is required for proper lamination of mouse retina.
J. of Neurosci., 25, 10290-10298 (2005)
Saito, H., Tsumura, H., Otake, S., Nishida, A., Furukawa, T., Suzuki N.
L7/Pcp-2-specific expression of Cre recombinase using knock-in approach.
BBRC, 331, 1216-1221 (2005)
Morrow, E.M., Furukawa, T., Raviola, E., Cepko, C.L.
Synaptogenesis and outer segment formation are peturbed in the neural retina.
BMC Neuroscience, 6, 1471-2205 (2005)
Nishida, A., Furukawa, A., Koike, C., Tano, Y., Aizawa, S., Matsuo, I., Furukawa, T.
Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal gland development.
Nature Neurosci., 6, 1255-1263 (2003)
論文解説③
Furukawa, A., Koike, C., Lippincott, P., Cepko, C.L., Furukawa, T.
The mouse Crx 5’ upstream transgene sequence directs a cell-specific and developmentally regulated expression in retinal photoreceptor cells.
J. of Neurosci., 22,1640-1647 (2002)
Blackshaw, S., Fraioli, R.E., Furukawa, T., Cepko, C.L.
Comprehensive Analysis of Photoreceptor Gene Expression and the Identification of Candidate Retinal disease Genes.
Cell, 107, 579-589 (2001)
Furukawa,T., Shiddartha, M., Bao, Z-Z, Morrow, E.M., Cepko, C.L.
rax, Hes1 and Notch1 promote the formation of Muller glia by postnatal retinal progenitor cells.
Neuron, 26, 383-394 (2000)
Livesey, F.J. Furukawa, T., Steffen, M., Church, G.M., Cepko, C.L
Microarray anaysis of the transcriptional netwaork controlled by the photoreceptor-specific homeobox gene Crx.
Curr Biol, 10, 301-310 (2000)
*Furukawa, T., Morrow, E.M., Li, T., Davis, F.C., *Cepko, C.L.
Retinopathy and attenuated circadian entrainment in Crx-deficient mice.
Nature Genet., 23, 466-470 (1999)
(*Corresponding author)
*Schulte, D., *Furukawa, T., *Peters, M.A., Kozak, C.A., Cepko, C.L. Misexpression of the Emx-related homeobox genes cVax and mVax2 ventralizes the retina and perturbs the retinotectal map.
Neuron, 24, 541-553 (1999)
(*First three authors contributed equally to this work.)
Morrow, E.M., Furukawa, T., Lee. J.E., Cepko, C.L.
Neuro D regulates cell fate determination in the Developing neural retina.
Development, 126, 23-36 (1999)
Morrow, E.M., Furukawa, T., Cepko, C.L.
Vertebrate photoreceptor cell development and disease.
Trends in Cell Biol., 8, 353-358 (1998)
Taniguchi, Y., Furukawa, T., Tun, T., Han, H., Honjo, T.
LIM protein KyoT2 negatively regulates transcription by association with the RBP-JDNA-binding protein.
Mol Cell Biol., 18, 644-654 (1998)
Furukawa, T., Morrow, E.M., Cepko, C.L.
Crx, a novel otx-like homeobox gene, shows photoreceptor-specific expression and regulates photoreceptor differentiation.
Cell, 91, 531-541 (1997)
*Freund, C.L., *Gregory-Evans, C.Y., *Furukawa, T., Papaioa
Omori Y, Kubo S, Kon T, Furuhashi M, Narita H, Kominami T, Ueno A, Tsutsumi R, Chaya T, Yamamoto H, Suetake I, Ueno S, Koseki H, Nakagawa A and Furukawa T
Proc Natl Acad Sci U S A. 2017.
<研究成果のポイント>
・網膜の視細胞のアイデンティティーがエピジェネティックに制御されていることを発見。
・脳や網膜の神経細胞の終末分化がエピジェネティックに制御されているかどうかは、これまであまりよく分かっていなかった。
・夜盲などの網膜の機能低下のメカニズム解明や網膜再生医療研究の基盤となる成果。
<概要>
大阪大学蛋白質研究所の大森義裕准教授、久保竣(大学院生)及び古川貴久教授の研究チームは、名古屋大学、理化学研究所との共同研究で、眼の網膜にある光センサー細胞(網膜視細胞)におけるエピジェネティックな制御の仕組みを解明し、神経発生における重要性を明らかにしました。
脳や網膜の神経細胞の終末分化がエピジェネティックに制御されているかどうかは、これまであまりよく分かっていませんでした。そこで、大森准教授らの研究グループは、桿体(かんたい)視細胞に発現するSamd7(サムディーセブン)という蛋白質が、その構造からエピジェネティックな制御に関わっている可能性があると注目しました。Samd7のノックアウトマウスを作製し解析したところ、Samd7ノックアウトマウスの眼の網膜では、本来、桿体視細胞ではまったく発現しない青色オプシンが強く発現しており、逆に、もとから桿体視細胞にある桿体オプシンの量が半減していることがわかりました(図1)。
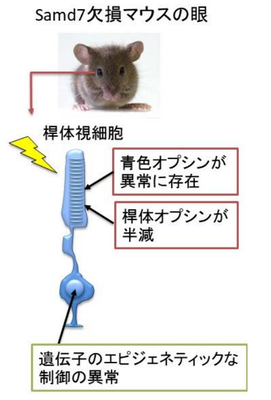
Samd7欠損マウスの眼の光センサー細胞(桿体視細胞)では青色オプシンが異常に存在し、桿体オプシンが半減し、視細胞の機能が低下する。Samd7がオプシンのエピジェネティックな制御を行うことを発見した。
神経細胞のアイデンティティー形成にエピジェネティック制御が重要であることがノックアウトマウスを用いた研究で明らかとなりました。この成果は、網膜視細胞や神経細胞のアイデンティティー形成の仕組みを理解する上で大きな前進となるものです。 本研究成果は、2017年9月12日(火)午前4時(日本時間)に科学誌「米国アカデミー紀要 Proceedings of the National Academy of Sciences of the United States of America(PNAS)」に公開されました。
<研究の背景>
ヒトを含む脊椎動物の眼の網膜には視細胞と呼ばれる光センサー細胞があります。ヒトの場合、赤色・青色・緑色の色を見分ける錐体視細胞と、明暗を見分ける桿体視細胞があります。発生過程において、赤色・青色・緑色の錐体視細胞と桿体視細胞のそれぞれには波長特性が異なるオプシン※1と呼ばれる光センサーたんぱく質が発現して最終的な細胞分化が完成することが知られています。例えば、赤色錐体視細胞には赤色オプシンのみが発現し、桿体視細胞には桿体オプシンのみが発現します。オプシン以外にも、錐体視細胞と桿体視細胞ではそれぞれ錐体型、桿体型の多くの異なる光受容たんぱく質が発現していますが、このような視細胞のアイデンティティーを確立する仕組みは十分に解明されていませんでした。
<研究の内容>
今回、大森准教授らの研究グループは、桿体視細胞においてオプシンをはじめとする様々な遺伝子がエピジェネティックな制御を受けて視細胞のアイデンティティーを確立することを明らかにしました。
エピジェネティック制御とはDNAの配列変化によらない遺伝子発現の制御・伝達機構のことで、多細胞生物の発生・分化や癌、精神疾患など疾患発症とも深い関わりがあり、近年、環境と生物の関わりを制御する仕組みとして注目されています。
本研究において、大森准教授らの研究グループは、桿体視細胞に発現するSamd7(サムディーセブン)という蛋白質が、その構造からエピジェネティックな制御に関わっている可能性があると注目しました。Samd7のノックアウトマウスを作製し解析したところ、Samd7ノックアウトマウスの眼の網膜では、本来、桿体視細胞ではまったく発現しない青色オプシンが強く発現しており(図2)、逆に、もとから桿体視細胞にある桿体オプシンの量が半減していることがわかりました。そのため、Samd7ノックアウトマウスでは桿体視細胞の機能が低下していることが明らかとなりました(図3)。ヒトでは夜盲と呼ばれる暗い場所で物が見えにくくなる視覚障害が知られていますが、Samd7ノックアウトマウスは夜盲に近い症状をもつと考えられます。
Samd7と結合する蛋白質の探索から、ポリコーム抑制複合体※2と呼ばれるエピジェネティックな制御因子がSamd7と結合することがわかりました。Samd7はポリコーム抑制複合体を介して、ヒストンのメチル化とユビキチン化を制御し、青色オプシンの他にも少なくとも約400個の遺伝子を制御していることがわかり、Samd7が桿体視細胞のアイデンティティーの確立に必須の役割を果たすことが証明されました(図4)。
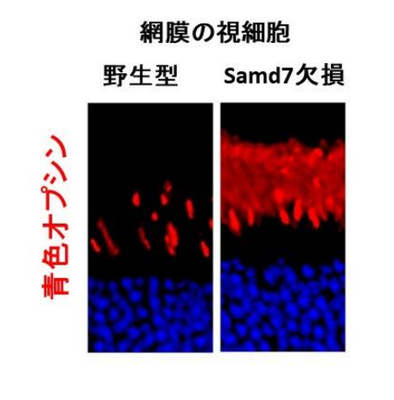
野生型およびSamd7欠損マウスの視細胞に存在する青色オプシン蛋白質を蛍光で染色した。野生型では錐体視細胞にしか存在しない青色オプシンがSamd7欠損マウスでは桿体視細胞においても異常に発現することが確認された。
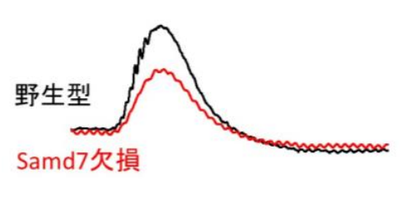
マウスに暗闇の中で光を当て、その電気的反応を記録した(網膜電図)。Samd7欠損マウスでは神経細胞の反応が弱く視細胞の機能が低下していることがわかる。
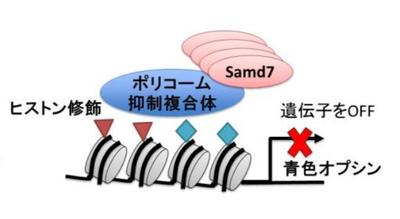
Samd7が青色オプシン遺伝子を制御する仕組み。Samd7は桿体視細胞の核の中でポリコーム抑制複合体(エピジェネティック因子)と結合し、染色体上のDNAを巻き付けているヒストンと呼ばれる蛋白質を修飾することで青色オプシンの遺伝子のスイッチをOFFにする役割を持つことが解明された。
<本研究成果が社会に与える影響(本研究成果の意義)>
今回の成果は、今まで明らかでなかった桿体視細胞のエピジェネティックな遺伝子制御機構を解明したことによって、視細胞のアイデンティティー確立の仕組みの理解につながるものです。視細胞分化のメカニズムをエピジェネティックな観点から解明した初めての研究であり、夜盲などの網膜の機能低下のメカニズム解明や網膜再生医療研究の基盤となると考えられます。
<用語説明>
※1 オプシン
青色錐体視細胞には青色オプシン、赤色錐体視細胞には赤色オプシン、緑色錐体視細胞には緑色オプシン、桿体視細胞には桿体オプシンのみが発現しており、これらのオプシンの発現は厳密に制御されている。
※2 ポリコーム抑制複合体
ポリコーム抑制複合体RC(polycomb repressive complex)は2つの複合体PRC1,PRC2から成り、ヒストンのメチル化やユビキチン化といったヒストン修飾を制御することで、遺伝子発現の制御を行うエピジェネティック因子である。
Taro Chaya, Akihiro Matsumoto, Yuko Sugita, Satoshi Watanabe, Ryusuke Kuwahara, Masao Tachibana, Takahisa Furukawa
Sci Rep. 2017 Jul 17;7(1):5540.
<研究成果のポイント>
◆ 網膜において最も数の少ない細胞種(水平細胞)が、視覚に重要な役割を果たすことを発見した。
◆ これまで水平細胞が個体レベルの視覚にどのように寄与しているかは明らかではなかった。
◆ 失明に対する、再生医療をはじめとした視覚再建法の開発に向けた基盤となる知見と考えられる。
<概要>
大阪大学蛋白質研究所の古川貴久教授、東京大学大学院人文社会系研究科の立花政夫名誉教授らの研究グループは、網膜において最も数が少ない細胞種である水平細胞が、視覚の形成に重要な役割を担うことを明らかにしました。
これまで網膜水平細胞について、細胞レベルでの役割は詳細に解析されてきましたが、網膜の神経回路(図1)レベルの機能についてはあまり理解が進んでおらず、個体の視覚にどのように寄与するのかは不明でした。
今回、古川教授らの研究グループは、網膜において水平細胞を選択的に欠失させることができるマウスモデルの作製に成功し、このマウスの視覚機能を解析することにより、水平細胞が多様な側面から視覚に重要な役割を担っていることを解明しました。本研究は、網膜における視覚情報の処理メカニズムの理解を推し進めるだけでなく、網膜色素変性症などによる失明に対する、再生医療をはじめとした視覚再建法の開発に向けた基盤となる知見をもたらすと考えられます。
本研究成果は、英国科学誌「Scientific Reports」に、7月17日(月)に公開されました。
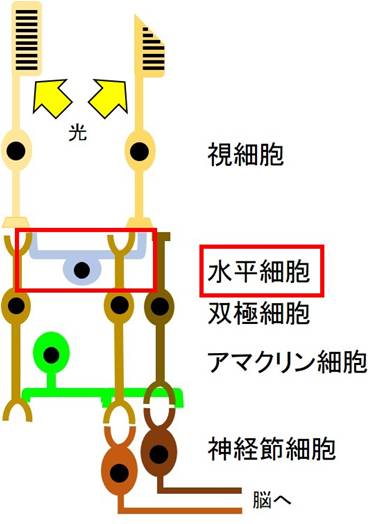 <研究の背景>
<研究の背景>
網膜は眼球の後方に位置する神経組織であり、主に5種類の神経細胞から構成され、これらの神経細胞により神経回路が構築されています(図1)。網膜において外界の光情報は電気信号へと変換され、この神経回路を経て脳へと伝達されます。このうち水平細胞は、光を受容する視細胞、視細胞からのシグナルを受け取る双極細胞の2種類の神経細胞と接続する、網膜において最も数が少ない細胞種です。 水平細胞についてはこれまで主に阻害剤等を用いた薬理学的手法により、細胞レベルでの機能メカニズムは詳細に解明されてきました。しかしながら、水平細胞の神経回路レベルでの機能についてはあまり理解が進んでおらず、個体の視覚にどのように寄与するのかは明らかになっていませんでした。
<研究の内容>
古川教授らの研究グループは、網膜から選択的に水平細胞を欠失させることができるマウスモデルを作製しました。このマウスの視覚機能を調べた結果、水平細胞は視覚情報の処理において多様な側面で関与していることが明らかになりました。 具体的には水平細胞欠損マウスにおいて、 1)網膜の出力細胞である神経節細胞の発火を引き起こすことができる光刺激の領域(受容野)が拡大しました。
2)光に対する神経節細胞ごとに異なる応答の多様性が減少しました。
3)神経節細胞の周囲の光強度に応じた応答の順応(明順応)が低減しました。
4)個体レベルでの視覚感度の上昇が観察されました。
以上より、水平細胞はこれまで知られていた受容野の形成のみならず、神経節細胞の機能的な多様性や明順応、視覚感度の調節に重要な役割を果たしていることが明らかになりました。
<本研究成果が社会に与える影響(本研究成果の意義)>
本研究により、網膜における視覚の情報処理メカニズムの理解が進みました。さらに本研究を含め、外界の光情報を網膜がどうようにして脳において適切に読み解けるように処理しているのかを明らかにすることは、網膜色素変性症等による失明に対する視覚再建を実際の視覚により近いレベルで達成する足掛かりとなることが期待されます。
Okamoto S, Chaya T, Omori Y, Kuwahara R, Kubo S, Sakaguchi H and Furukawa T
J. of Neurosci, 2017, Feb 22;37(8): 2073-2085.
<研究の背景>
音の認知は、耳で受容された音が脳へ伝達されることにより行われます。 まず音は外耳・中耳で増幅され、内耳に到達します。内耳では音により生じる振動という機械的刺激が電気信号に変換され、脳へと伝達されます。 この音の伝達経路のいずれかの部位が障害された場合に難聴となり、外耳もしくは中耳に障害がある場合は伝音難聴、内耳に障害がある場合は感音難聴と呼ばれます。 先天性難聴は出生数約1000人に1人の割合で起こるとされ、この多くは感音難聴であることが知られています。また先天性難聴の約半数は遺伝性難聴であることが報告されています。 一方、繊毛症と呼ばれる、繊毛の機能異常により引き起こされる遺伝性疾患の中に、感音難聴を伴うものがあります。 繊毛は細胞表面より突出する構造物であり、運動機能を持つものや、細胞外シグナルを受容する感覚器としての機能を持つものがあります。 また繊毛は全身の臓器で重要な役割を果たしており、内耳においても繊毛を構成する蛋白質が発生期において機能していることが知られています。 しかし、このような繊毛蛋白質の機能を制御している酵素が内耳においてどのような役割を果たしているか、ということは明らかにされていませんでした。
<研究内容>
当研究グループは以前、リン酸化酵素のIntestinal cell kinase (ICK)が繊毛内の蛋白質輸送に必須であることを明らかにしていました。 今回、京都府立医科大学耳鼻咽喉科・頭頸部外科学教室の岡本志央医師ならびに坂口博史准教授との共同研究で、ICKがマウスの内耳にも発現していることを見出しました。 内耳における音の受容器官である蝸牛の有毛細胞頂面の構造は非対称となっています。有毛細胞の頂面には不動毛と呼ばれる感覚毛がV字型もしくは弧状に配列しています。 また発生期にはV字または弧の頂点に1本の動毛と呼ばれる繊毛が存在していますが、発生が進むにつれて退縮し、成体では消失します。 不動毛は動毛に隣接する部位で最も長く、動毛から離れるほど短くなる階段状に並んでいます。平面内細胞極性と呼ばれるこの非対称性こそが聴覚にとって重要であることが知られています 。また有毛細胞と有毛細胞の間には支持細胞があり、支持細胞の頂面にも繊毛が存在しています。 ICK欠損マウスの蝸牛有毛細胞では不動毛の配列や動毛の位置に異常が見られ、平面内細胞極性が障害されていると考えられました。 また繊毛内輸送に関わる蛋白質であるIFT88が動毛の先端に集積していました。また支持細胞の繊毛においてもIFT88が先端に集積しており、さらに繊毛は伸長していました。 全身でICKを欠損させたマウスは胎生致死となるため、ICKを内耳特異的に欠損させたところ、生直後において、全身における欠損マウスと同様に有毛細胞における平面内細胞極性の障害や、支持細胞の繊毛の伸長が見られました。ICKを内耳特異的に欠損させた成体マウスにおいては難聴が認められました。 また聴覚が障害される周波数と平面内細胞極性の障害部位は一致しており、平面内細胞極性の障害により難聴が引き起こされると考えらえました。 これらの結果よりICKは内耳において繊毛形成と蝸牛有毛細胞の平面内細胞極性を制御することにより、聴覚機能において重要な役割を果たしていることが明らかになりました。
Watanabe S, Sanuki R, Sugita Y, imai W, Yamazaki R, Kozuka T, Ohsuga M, Furukawa T.
J. of Neurosci, 2015, May 20;35(20): 8004-20.
Prdm13は網膜アマクリン細胞のサブタイプ分化と視覚感度を制御する
〜Prdm13欠損マウスでは視覚応答感度が上昇する!〜
近年、中枢神経系におけるインターニューロン(介在神経細胞)が果たす役割が注目されている。インターニューロンは、局所の神経回路で神経細胞の活動を調節し、多様なサブタイプが存在する。大脳皮質のインターニューロンの機能障害は、てんかん、自閉症、統合失調症などの精神神経疾患に関連することが知られており、インターニューロンのサブタイプ分化機構や生理機能に関する研究は、神経科学および医学において非常に重要なテーマとなっている。
今回、私たちは網膜のインターニューロンであるアマクリン細胞の一部に転写因子Prdm13が特異的に発現していることを見出した。Prdm13を発現する細胞の多くはGABAやグリシンを神経伝達物質とする抑制性神経細胞であった。Prdm13欠損マウスを作製したところ、アマクリン細胞の約3割が消失した。またPrdm13を発生期の網膜に強制発現するとGABAまたはグリシン作動性アマクリン細胞の分化を強く促進したが、Prdm13はアセチルコリン作動性のアマクリン細胞は誘導しなかったことから、Prdm13が一部のアマクリン細胞の分化に関わることが示唆された。
さらに興味深いことに、Prdm13欠損マウスは視覚刺激に対する応答感度が上昇していた。私たちが知る限り、Prdm13欠損マウスは視覚応答感度が上昇するノックアウトマウスの最初の例である。本研究から、Prdm13が発現するアマクリン細胞は適切な視覚応答感度の調節に重要であることが明らかになった。
Omori Y, Chaya T, Katoh K, Kajimura N, Sato S, Muraoka K, Ueno S, Koyasu T, Kondo M, Furukawa T. Proc Natl Acad Sci U S A. 2010 Dec 8
「繊毛キナーゼMakによる繊毛の長さ制御は網膜視細胞の生存に必須である」
網膜色素変性症は、眼の網膜に存在する視細胞が、変性することにより、視覚障害を引き起こす疾患であるが、その根本的な治療法は確立されていない。網膜色素変性症の原因遺伝子のひとつにRP1があるが、RP1が網膜色素変性症を引き起こす仕組みは明らかではなかった。眼の網膜では、視細胞と呼ばれる神経細胞が光センサーの役割を果たしている。視細胞には、光センサーの役割を果たす外節が発達する。この外節は、繊毛(cilia)と呼ばれる微小管を軸とした構造がベースとなっている。視細胞の繊毛が正常に作られる仕組みはこれまでよくわかっていなかった。 我々は、マイクロアレイを用いたスクリーニングにより、機能未知キナーゼであるMAKが網膜の視細胞に発現することを見出した。MAK遺伝子を欠損したマウスでは、ヒトの網膜色素変性症に似た症状が見られることを発見した。このマウスでは、生後12カ月までにゆっくりとした視細胞の変性が見られた。このマウスは、光を感知する能力が劣っていることが、電気生理学的な実験からわかった。そこで、網膜の組織を詳細に観察したところ、興味深いことに、このMAK欠損マウスでは、視細胞の繊毛と呼ばれる神経細胞の「アンテナ」の部分が異常に伸びて長くなっていた。更に、分子生物学的な手法により、このMAKが網膜色素変性症の原因遺伝子であるRP1をリン酸化することで、繊毛の長さを調節していることを発見した。この研究は、神経細胞のアンテナである繊毛が「伸びすぎること」が網膜色素変性症の原因となりうることを見出した研究であり、今後の展開が期待される。
網膜視細胞は錐体・桿体の2種類の細胞からなり、眼球の後方に位置し、哺乳類において唯一の光センサーとして働きます。網膜視細胞は、その解剖学的および臨床的重要性から多くの研究がなされてきましたが、発生メカニズムについてはまだ十分に解明されていませんでした。また、松果体については、体内リズムとの関連について多くの研究がなされてきましたが、その発生メカニズムは不明でした。
我々は以前より網膜視細胞の発生機構を明らかにしようと研究してきました。以前の研究で、我々は網膜視細胞と松果体に特異的に発現する転写因子Crxを単離し、いくつかの網膜変性疾患の原因遺伝子であることを明らかにしました。その後、ノックアウトマウスの解析により、Crxが視細胞における光受容反応および松果体におけるメラトニン合成に重要であることを示しました。しかしながら、Crxのホモ接合ノックアウトマウスにおいても視細胞の初期発生がみられることから、Crxと機能的に重複する遺伝子の存在が示唆されていました。そこで今回、Crxと同じOtxファミリーに属し、網膜における発現が報告されているOtx2に注目しました。Otx2はショウジョウバエの遺伝子orthodenticleの哺乳類におけるホモログとしてクローニングされ、前脳、中脳、松果体、神経網膜、網膜色素上皮といった組織における発現が報告されています。我々は最近の研究において、視細胞が網膜幹細胞から分化する際の最初の鍵を握る遺伝子がOtx2であることを明らかにしました。
まず、in situ hybridizationによりOtx2の時間的、空間的発現パターンをCrxと比較しました。Otx2の神経網膜における発現はCrxよりもやや先行して発生過程の視細胞にみられましたが、生後網膜では視細胞での発現がほとんどみられなくなりました。次に、Otx2の網膜視細胞発生における役割を調べるために、コンディショナルノックアウトマウスを解析しました。Otx2のホモ接合ノックアウトマウスは胎生致死ですので、Crxプロモーターの制御下に網膜視細胞および松果体において特異的にOtx2の発現が消失するようなコンディショナルノックアウトマウスを作成しました。Otx2コンディショナルノックアウトマウスでは、網膜視細胞の発生はみられず、網膜神経細胞の一種であるアマクリン細胞が著明に増加していました。これは、本来であれば網膜視細胞に分化すべき細胞が、Otx2の機能消失により、アマクリン細胞へと細胞運命を転換したと考えられます。また、松果体は完全に欠損していました。Otx2コンディショナルノックアウトマウスの網膜における各種転写因子の発現を調べたところ、Crxの発現が著しく低下していました。また、レトロウィルスベクターを用いてラットの網膜未分化前駆細胞にOtx2を強制発現させると、アマクリン細胞、双極細胞、ミューラー細胞への分化が抑制され、視細胞への分化が促進ました。さらに、Crxのプロモーター領域を用いてルシフェラーゼアッセイを行い、Otx2がCrxプロモーター上のOTX結合部位を介してCrxの発現を制御することを示唆するデータが得られました。これらの結果から、Otx2は網膜視細胞の運命決定に必要かつ十分であり、またCrxの上流遺伝子として働くことが示されました。
この研究で、Otx2が網膜視細胞および松果体の初期発生を制御する最上流に位置する遺伝子であることが明らかになりました。今後、網膜幹細胞や神経幹細胞にOtx2を導入することにより、視細胞への分化誘導が可能になると期待されます。この研究は、現在の医学では治療の方法がない難治性網膜疾患の治療につながる研究であると考えられます。
Title
Journal
Koki Kobayashi, Taro Chaya, Hung-Ya Tu, Yamato Maeda, Yuki Nakashima, Ryotaro Tsutsumi, Haruka Yamamoto, Toshinori Tsujii, Daisuke Okuzaki and Takahisa Furukawa
Dysfunction of Unc119, a transducin-binding protein, leads to cone-rod dystrophy through activating JAK-STAT and NF-κB inflammatory pathways in the mouse retina
Journal of Neuroscience
https://doi.org/10.1523/JNEUROSCI.2245-24.(2025)
https://www.jneurosci.org/content/early/2025/10/16/JNEUROSCI.2245-24.2025
Yuko Sugita, Koki Kobayashi, Hung-Ya Tu, Daisuke Okuzaki, Takahisa Furukawa
Blackcurrant anthocyanins improve visual contrast resolution for optokinetic responses in aging mice
Neuroscience
https://doi.org/10.1016/j.neuroscience.2025.09.003(2025)
https://www.sciencedirect.com/science/article/pii/S0306452225009170
Kazuki Fujieda, Hitoshi Sumihiro, Rika Saito, Koki Kobayashi, Yuki Miyanohara, Shinya Abe, Toshinori Tsujii, Hung-Ya Tu, Takahisa Furukawa
Id2 transcriptional repressor promotes retinal Müller glial cell fate choice by increasing Notch activity
Biochemical and Biophysical Research Communications
https://doi.org/10.1016/j.bbrc.2025.151966(2025)
https://www.sciencedirect.com/science/article/pii/S0006291X25006801?via%3Dihub
Taro Chaya, Yamato Maeda, Ryotaro Tsutsumi, Makoto Ando, Yujie Ma, Naoko Kajimura, Teruyuki Tanaka, Takahisa Furukawa
Ccrk-Mak/Ick signaling is a ciliary transport regulator essential for retinal photoreceptor survival
Life Science Alliance
https://doi.org/10.26508%2Flsa.202402880 (2024)
https://www.life-science-alliance.org/content/7/11/e202402880
Leah Rie Varner, Taro Chaya, Yamato Maeda, Ryotaro Tsutsumi, Shanshan Zhou, Toshinori Tsujii, Daisuke Okuzaki, Takahisa Furukawa
The deubiquitinase Otud7b suppresses cone photoreceptor degeneration in mouse models of retinal degenerative diseases
iScience
https://doi.org/10.1016/j.isci.2024.109380 (2024)
https://www.cell.com/iscience/fulltext/S2589-0042(24)00601-1
Takuya Yoshimoto, Taro Chaya, Leah R. Varner, Makoto Ando, Toshinori Tsujii, Daisuke Motooka, Kazuhiro Kimura, Takahisa Furukawa The Rax homeoprotein in Müller glial cells is required for homeostasis maintenance of the postnatal mouse retina
Journal of Biological Chemistry
https://doi.org/10.1016%2Fj.jbc.2023.105461 (2023)
https://www.jbc.org/article/S0021-9258(23)02489-4/fulltext
Taro Chaya, Yamato Maeda, Ryo Sugimura, Haruka Yamamoto, Hidemasa Kato, Takahisa Furukawa
Multiple knockout mouse and embryonic stem cell models reveal the role of miR-124a in neuronal maturation
Journal of Biological Chemistry
https://doi.org/10.1016%2Fj.jbc.2022.102293 (2022)
https://www.jbc.org/article/S0021-9258(22)00735-9/fulltext
Ryotaro Tsutsumi, Taro Chaya, Toshinori Tsujii, Takahisa Furukawa
The carboxyl-terminal region of SDCCAG8 comprises a functional module essential for cilia formation as well as organ development and homeostasis
Journal of Biological Chemistry
https://doi.org/10.1016/j.jbc.2022.101686 (2022)
https://www.jbc.org/article/S0021-9258(22)00126-0/fulltext
Taro Chaya, Hiroshi Ishikane, Leah R Varner, Yuko Sugita, Yamato Maeda, Ryotaro Tsutsumi, Daisuke Motooka, Daisuke Okuzaki, Takahisa Furukawa
Deficiency of the neurodevelopmental disorder-associated gene Cyfip2 alters the retinal ganglion cell properties and visual acuity
HUMAN MOLECULAR GENETICS
https://doi.org/10.1093/hmg/ddab268
https://academic.oup.com/hmg/advance-article/doi/10.1093/hmg/ddab268/6368510
Daichi Gyoten, Shinji Ueno, Satoshi Okado, Taro Chaya, Shunsuke Yasuda, Takeshi Morimoto, Mineo Kondo, Kazuhiro Kimura, Takaaki Hayashi, Bart P Leroy, Se Joon Woo, Ryo Mukai, Kwangsic Joo, Takahisa Furukawa
Broad locations of antigenic regions for anti-TRPM1 autoantibodies in paraneoplastic retinopathy with retinal ON bipolar cell dysfunction
Experimantal Eye Research
https://doi.org/10.1016/j.exer.2021.108770
https://www.sciencedirect.com/science/article/abs/pii/S0014483521003365?via%3Dihub
Shun Kubo, Haruka Yamamoto, Naoko Kajimura, Yoshihiro Omori, Yamato Maeda, Taro Chaya, Takahisa Furukawa
Functional analysis of Samd11, a retinal photoreceptor PRC1 component, in establishing rod photoreceptor identity
Scientific Reports
https://doi.org/10.1038/s41598-021-83781-1
https://www.nature.com/articles/s41598-021-83781-1
Takefumi Sugiyama, Haruka Yamamoto, Tetsuo Kon, Taro Chaya, Yoshihiro Omori, Yutaka Suzuki, Kentaro Abe, Dai Watanabe, Takahisa Furukawa
The potential role of Arhgef33 RhoGEF in foveal development in the zebra finch retina
Scientific Reports
https://doi.org/10.1038/s41598-020-78452-6
https://www.nature.com/articles/s41598-020-78452-6
Yuko Sugita, Haruka Yamamoto, Yamato Maeda, Takahisa Furukawa
Inluence of aging on the retina and visual motion processing for optokineic responses in mice
Frontiers in Neuroscience
https://doi.org/10.3389/fnins.2020.586013
https://www.frontiersin.org/articles/10.3389/fnins.2020.586013/full
Tetsuo Kon, Takahisa Furukawa
Origin and evolution of the Rax homeobox gene by comprehensive evolutionary analysis
FEBS open bio
https://doi.org/10.1002/2211-5463.12832
https://febs.onlinelibrary.wiley.com/doi/full/10.1002/2211-5463.12832
Yuko Sugita, Kenichiro Miura, Takahisa Furukawa
Retinal ON and OFF pathways contribute to initial optokinetic responses with different temporal characteristics
European Journal of Neuroscience
https://doi.org/10.1111/ejn.14697
https://onlinelibrary.wiley.com/doi/full/10.1111/ejn.14697?af=R
Haruka Yamamoto, Tetsuo Kon, Yoshihiro Omori, Takahisa Furukawa
Functional and Evolutionary Diversification of Otx2 and Crx in Vertebrate Retinal Photoreceptor and Bipolar Cell Development
Cell Reports
https://doi.org/10.1016/j.celrep.2019.212.072
https://www.cell.com/cell-reports/fulltext/S2211-1247(19)31729-2
Taro Chaya, Ryotaro Tsutsumi, Leah Rie Varner, Yamato Maeda, Satoyo Yoshida, Takahisa Furukawa
Cul3‐Klhl18 ubiquitin ligase modulates rod transducin translocation during light‐dark adaptation
EMBO J.
https://doi.org/10.15252/embj.2018101409
https://www.embopress.org/doi/10.15252/embj.2018101409
Takashi Kozuka, Yoshihiro Omori, Satoshi Watanabe, Etsuko Tarusawa, Haruka Yamamoto, Taro Chaya, Mayu Furuhashi, Makiko Morita, Tetsuya Sato, Shinichi Hirose, Yasuyuki Ohkawa, Yumiko Yoshimura, Takatoshi Hikida & Takahisa Furukawa
miR-124 dosage regulates prefrontal cortex function by dopaminergic modulation
Scientific Reports
https://doi.org/10.1038/s41598-019-38910-2
https://www.nature.com/articles/s41598-019-38910-2
Ryotaro Tsutsumi, Taro Chaya, Takahisa Furukawa
Enriched expression of the ciliopathy gene Ick in cell proliferating regions of adult mice
Gene Expression Patterns
doi:10.1016/j.gep.2018.04.005
https://www.sciencedirect.com/science/article/pii/S1567133X18300140
Akiko Ueno, Yoshihiro Omori, Yuko Sugita, Satoshi Watanabe, Taro Chaya, Takashi Kozuka, Tetsuo Kon, Satoyo Yoshida, Kenji Matsushita, Ryusuke Kuwahara, Naoko Kajimura, Yasushi Okada, Takahisa Furukawa
Lrit1, a Retinal Transmembrane Protein, Regulates Selective Synapse Formation in Cone Photoreceptor Cells and Visual Acuity
Cell Reports 22, 3548–3561 March 27, 2018
doi:10.1016/j.celrep.2018.03.007
http://www.cell.com/cell-reports/fulltext/S2211-1247(18)30321-8
Michio Miyajima, Baihao Zhang, Yuki Sugiura, Kazuhiro Sonomura, Matteo M Guerrini, Yumi Tsutsui, Mikako Maruya, Alexis Vogelzang, Kenji Chamoto, Kurara Honda, Takatoshi Hikida, Satomi Ito, Hongyan Qin, Rikako Sanuki, Keiichiro Suzuki, Takahisa Furukawa, Yasushi Ishihama, Fumihiko Matsuda, Makoto Suematsu, Tasuku Honjo and Sidonia Fagarasan
Metabolic shift induced by systemic activation of T cells in PD-1-deficient mice perturbs brain monoamines and emotional behavior
Nature Immunology.
doi:10.1038/ni.3867
https://www.nature.com/articles/ni.3867
Kozuka T, Chaya T, Tamalu F, Shimada M, Fujimaki-Aoba K, Kuwahara R, Watanabe SI, Furukawa T.
The TRPM1 channel is required for development of the rod ON bipolar cell-AII amacrine cell pathway in the retinal circuit.
J Neurosci. 2017 Sep 12.
pii: 0824-17. http://www.jneurosci.org/content/early/2017/09/12/JNEUROSCI.0824-17.2017
Omori Y, Kubo S, Kon T, Furuhashi M, Narita H, Kominami T, Ueno A, Tsutsumi R, Chaya T, Yamamoto H, Suetake I, Ueno S, Koseki H, Nakagawa A and Furukawa T
Samd7 is a cell type-specific PRC1 component essential for establishing retinal rod photoreceptor identity.
Proc Natl Acad Sci U S A. 2017. 論文解説⑥
Taro Chaya, Akihiro Matsumoto, Yuko Sugita, Satoshi Watanabe, Ryusuke Kuwahara, Masao Tachibana and Takahisa Furukawa
Versatile functional roles of horizontal cells in the retinal circuit.
Sci Rep. 2017 Jul 17;7(1):5540. 論文解説⑤
Okamoto S, Chaya T, Omori Y, Kuwahara R, Kubo S, Sakaguchi H and Furukawa T
Ick ciliary kinase is essential for planar cell polarity formation in inner ear hair cells and hearing function
J. of Neurosci, 2017, Feb 22;37(8): 2073-2085. 論文解説④
Irie S, Sanuki R, Muranishi Y, Kato K, Chaya T, Furukawa T
Rax Homeoprotein Regulates Photoreceptor Cell Maturation and Survival in Association with Crx in the Postnatal Mouse Retina.
Mol Cell Biol 35:2583–2596.
doi:10.1128/MCB.00048-15.
Omori Y, Chaya T, Yoshida S, Irie S, Tsujii T, Furukawa T.
Identification of G Protein-Coupled Receptors (GPCRs) in Primary Cilia and Their Possible Involvement in Body Weight Control.
PLoS One. 2015 Jun 8;10(6):e0128422.
doi: 10.1371/journal.pone.0128422. eCollection 2015.
Watanabe S, Sanuki R, Sugita Y, imai W, Yamazaki R, Kozuka T, Ohsuga M, Furukawa T.
Prdm13 Regulates Subtype Specification of Retinal Amacrine Interneurons and Modulates Visual Sensitivity.
J. of Neurosci, 2015, May 20;35(20): 8004-20. 論文解説①
Chaya T, Omori Y, Kuwahara R, Furukawa T.
ICK is essential for cell type-specific ciliogenesis and the regulation of ciliary transport.
EMBO J. 2014,
doi:10.1002/embj.201488175
Alves CH, Pellissier LP, Vos RM, Garcia Garrido M, Sothilingam V, Seide C, Beck SC, Klooster J, Furukawa T, Flannery JG, Verhaagen J, Seeliger MW & Wijnholds J
Targeted ablation of Crb2 in Photoreceptor Cells induces Retinitis Pigmentosa.
Hum Mol Genet. 2014,
doi:10.1093/hmg/ddu048
Mizuhashi K, Kanamoto T, Moriishi T, Muranishi Y, Miyazaki T, Terada K, Omori Y, Ito M, Komori T, Furukawa T
Filamin-interacting proteins, Cfm1 and Cfm2, are essential for the formation of cartilaginous skeletal elements.
Hum Mol Genet. 2014,
doi:10.1093/hmg/ddu007
Iida A, Iwagawa T, Kuribayashi H, Satoh S, Mochizuki Y, Baba Y, Nakauchi H, Furukawa T, Koseki H, Murakami A & Watanabe S
Histone demethylase Jmjd3 is required for the development of subsets of retinal bipolar cells.
Proc Natl Acad Sci USA, 2014,111(10): 3751-3756.
Kanda A, Noda K, Yuki K, Ozawa Y, Furukawa T, Ichihara A & Ishida S
Atp6ap2/(Pro)renin receptor interacts with Par3 as a cell polarity determinant required for laminar formation during retinal development in mice.
J. of Neurosci, 2013, 33(49): 19341-19351.
Yamazaki D, Funato Y, Miura J, Sato S, Toyosawa S, Furutani K, Kurachi Y, Omori Y, Furukawa T, Tsuda T, Kuwabata S, Mizukami S,Kikuchi K & Miki H
Basolateral Mg2+ Extrusion via CNNM4 Mediates, Transcellular Mg2+, Transport across Epithelia: A Mouse Model.
PLOS Gene. 2013, 9(12): e1003983.
Sugita Y, Miura K, Araki F, Furukawa T, Kawano & K.Eur
Contributions of retinal direction-selective ganglion cells to optokinetic responses in mice.
Eur J Neurosci. 2013, 38(6): 2823-31.
Eberhart A, Feodorava Y, Song C, Wanner G, Kiseleva E, Hake S, Furukawa T, Kimura H, Schotta G, Leonhardt H, Joffe B & Solovei I
Epigenetics of eu- and heterochromatin in inverted and conventional nuclei.
Chromosome Res. 2013, 20(5): 535-554.
Watanabe S, Sanuki R, Ueno S, Koyasu T, Hasegawa T, Furukawa T
Tropisms of AAV for subretinal delivery to the neonatal mouse retina and its application for in vivo rescue of developmental photoreceptor disorders.
PLoS One. 2013; 8(1):e54146.
Katoh K, Yamazaki R, Onishi A, Sanuki R, Furukawa T.
G9a histone methyltransferase activity in retinal progenitors is essential for proper differentiation and survival of mouse retinal cells.
J. of Neurosci. 2012, Dec 5;32(49):17658-70.
Muranishi Y & Furukawa T
BAC-Dkk3-EGFP Transgenic Mouse: An In Vivo Analytical Tool for Dkk3 Expression.
J Biomed Biotechnol. 2012:973140.
Peachey NS, Pearring JN, Bojang P, Jr., Hirschtritt ME, Sturgill-Short G, Ray TA, Furukawa T, Koike C, Goldberg AF, Shen Y, McCall MA, Nawy S, Nishina PM, & Gregg RG
Depolarizing Bipolar Cell Dysfunction due to a Trpm1 Point Mutation.
J Neurophysiol. 2012, 108(9):2442-2451.
Ochocinska MJ, Muñoz EM, Veleri S, Weller JL, Coon SL, Pozdeyev N, Michael Iuvone P, Goebbels S, Furukawa T & Klein DC
NeuroD1 is required for survival of photoreceptors but not pinealocytes: Results from targeted gene deletion studies.
J Neurochem. 2012, 123(1):44-59.
Omori Y, Araki F, Chaya T, Kajimura N, Irie S, Terada K, Muranishi Y, Tsujii T, Ueno S, Koyasu T, Tamaki Y, Kondo M, Amano S, Furukawa T.
Presynaptic Dystroglycan-Pikachurin Complex Regulates the Proper Synaptic Connection between Retinal Photoreceptor and Bipolar Cells.
J. of Neurosci. 2012 May 2;32(18): 6126-6137.
Muranishi Y, Terada K, Inoue T, Katoh K, Tsujii T, Sanuki R, Kurokawa D, Aizawa S, Tamaki Y, Furukawa T.
An Essential Role for RAX Homeoprotein and NOTCH–HES Signaling in Otx2 Expression in Embryonic Retinal Photoreceptor Cell Fate Determination.
J. of Neurosci. 2011, 31(46): 16792-16807
Sanuki, R., Onishi, A., Koike C., Muramatsu R., Watanabe S., Muranishi Y., Irie S., Uneo S., Koyasu T., Matsui R., Chérasse Y., Urade Y., Watanabe D., Kondo M., Yamashita T. & Furukawa T.
miR-124a is required for hippocampal axogenesis and retinal cone survival through Lhx2 suppression, Nature Neuroscience, 14, 1125–1134 (2011)
Pearring, J., Bojang Jr., P., Shen, Y., Koike, C., Furukawa, T., Nawy, S. & Gregg, R.
A Role for Nyctalopin, a Small Leucine-Rich Repeat Protein, in Localizing the TRP Melastatin 1 Channel to Retinal Depolarizing Bipolar Cell Dendrites.
J. of Neurosci. 31(27), 10060-10066 (2011)
*Omori, Y., *Katoh, K., *Sato, S., Muranishi, Y., Chaya, T., Onishi, A., Minami, T., Fujikado, T., & Furukawa, T.
Analysis of transcriptional regulatory pathways of photoreceptor genes by expression profiling of the Otx2-deficient retina.
PLoS ONE, 6(5), e19685 (2011)
(*First three authors contributed equally to this work.)
*Kondo, M., *Sanuki, R., Ueno, S., Nishizawa, Y., Hashimoto, N., Ohguro, H., Yamamoto, S., Machida, S., Terasaki, H., Adamus, Grazyna., & Furukawa, T.,
Indentification of autoantibodies against TRPM1 in patients with paraneoplastic retinopathy associated with ON bipolar cell dysfunction.
PLoS ONE, 6(5), e19911 (2011)
(*These authors contributed equally to this work.)
Okada, I., Hamanoue, H., Terada, K., Tohma, T., Megarbane, A., Chouery, E., Abou Ghoch, J., Jalkh, N., Cogulu, O., Ozkinay, F., Horie, K., Takeda, J., Furuichi, T., Ikegawa, S., Nishiyama, K., Miyatake, S.,
Nishimura, A., Mizuguchi, T., Niikawa, N., Hirahara, F., Kaname, T., Yoshiura, K., Tsurusaki, Y., Doi, H., Miyake, N., Furukawa, T., Matsumoto, N. & Saitsu, H.
SMOC1 is essential for ocular and limb development in humans and mice.
Am. J. Hum. Genet.,88, 1-12 (2010)
Omori Y., Chaya T., Katoh K., Kajimura N., Sato S., Muraoka K., Ueno S., Koyasu T., Kondo M., & Furukawa T.
Negative regulation of ciliary length by ciliary male germ cell-associated kinase (Mak) is required for retinal photoreceptor survival.
Proc. Natl. Acad. Sci. USA, 2010 Dec. 8 論文解説②
Katoh, K., Omori Y., Onishi A., Sato S., Kondo M. & Furukawa, T. Blimp1 Suppresses Chx10 Expression in Differentiating Retinal Photoreceptor Precursors to Ensure Proper Photoreceptor Development.
J. of Neurosci, 30(19):6515-6526 (2010)
Nakamura, M., Sanuki, R., Yasuma, R, T., Onishi, A., Nishiguchi, M, K., Kadowaki, M., Kondo, M., Miyake, Y. & Furukawa, T.
TRPM1 mutations are associated with the complete form of congenital stationary night blindness.
Mol. Vision 16:425-437 (2010)
Katahira, T., Nakagiri, S., Terada, K. & Furukawa, T.
Secreted factor FAM3C (ILEI) is involved in retinal laminar formation.
BBRC, 392(3), 301-306 (2010)
Muranishi, Y., Sato, S., Inoue, T., Ueno, S., Koyasu, T., Kondo, M. & Furukawa, T.
Gene expression analysis of embryonic photoreceptor precursor cells using BAC-Crx-EGFP transgenic mouse.
BBRC, 392(3), 317-322 (2010)
Sanuki, R., Omori, Y., Koike, C., Sato, S. & Furukawa, T.
Panky, a novel photoreceptor-specific ankyrin repeat protein, is a transcriptional cofactor that suppresses CRX-regulated photoreceptor genes.
FEBS Letters, 584, 753-758 (2009)
Koike, C., Obara, T., Uriu, Y., Numata, T., Sanuki, R., Miyata, K., Koyasu, T., Ueno, S., Funabiki, K., Tani, A., Ueda, H., Kondo, M., Mori Y., Tachibana, M. & Furukawa, T.
TRPM1 is a component of the retinal ON bipolar cell transduction channel in the mGluR6 cascade.
Proc. Natl. Acad. Sci. USA, 2009 Dec.4. Epub ahead of print (2009)
Kanamoto, T., Mizuhashi, K., Terada, K., Minami, T., Yoshikawa, H. & Furukawa, T.
Isolation and characterization of a novel plasma membrane protein, osteoblast induction factor (obif), associated with osteoblast differentiation.
BMC Developmental Biology, 9:70 (2009)
Cao, Y., Masuho, I., Okawa, H., Xie, K., Asami, J., Kammermeier, P., Maddox, D., Furukawa, T., Inoue, T., Sampath, A. & Martemyanov, K.
Retina Specific GTPase Accelerator RGS11/Gβ5S/R9AP is a Constitutive Heterotrimer Selectively Targeted to mGluR6 in ON-Bipolar Neurons.
J. of Neurosci., 29, 9301-9313 (2009)
Sasaki, T., Watanabe, W., Muranishi, Y., Kanamoto, T., Aibara M., Miyazaki, K., Tamura, H., Saeki, T., Oda, H., Souchelnytskyi, N., Souchelnytskyi, S., Aoyama, H., Honda, Z., Furukawa, T., Mishima. K. H., Kiuchi, Y. & Honda, H.
Elevated Intraocular Pressure, Optic Nerve Atrophy, and Impaired Retinal Development in ODAG Transgenic Mice.
IOVS, 50, No.1, 242-248 (2009)
Sato, S., Omori, Y., Katoh, K., Kondo, M., Kanagawa, M., Miyata, K., Funabiki, K., Koyasu, T., Kajimura, N., Miyoshi, T., Sawai, H., Kobayashi K., Tani, A., Toda, T., Usukura, J., Tano, Y., Fujikado, T., Furukawa,T.
Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation.
Nat Neuroscience, 11, 923-931 (2008)
Omori, Y., Zhao, C., Saras, A., Mukhopadhyay, S., Kim, W., Furukawa, T., Sengupta, P., Veraksa, A., Malicki, J.
Elipsa is an early determinant of ciliogenesis that links the IFT particle to membrane-associated small GTPase Rab8.
Nat Cell Biol., 10, 434-444 (2008)
Koike, C., Nishida, A.,Ueno, S., Saito, H., Sanuki, R., Sato, S., Furukawa, A., Aizawa, S.,Matsuo, I., Suzuki, N., Kondo, M., Furukawa, T.
Functional roles of Otx2 transcription factor in postnatal mouse retinal development.
Mol. Cell Biol. 27, 8318-8329 (2007)
Sato, S., Inoue, T., Terada, K., Matsuo, I., Aizawa, S., Tano, Y., Fujikado, T., Furukawa, T.
Dkk3-Cre BAC trasngenic mouse line: A tool for hilghly efficient gene deletion in retinal progenitor cells.
Genesis, 45, 502-507 (2007)
Terada, K., Kitayama, A., Kanamoto, T., Ueno, N., Furukawa, T.
Nucleosome regulator Xhmgb3 is essential for progenitor cell proliferation of the eye and brain.
Developmental Biology, 291, 298-412 (2006)
Inoue, T., Terada, K., Furukawa, A., Koike, C., Tamaki, Y., Araie, M., Furukawa, T.
Cloning and characterization of mr-s, a novel SAM domain protein, predominantly expressed in retinal photoreceptor cells.
BMC Developmental Biology, 6:15 (2006)
Kanamoto, T., Terada, K., Yoshikawa, H., Furukawa, T.
Cloning and regulation of the vertebrate homologue of lin-41 which functions as heterochronic gene in Caenorhabditis elegans.
Developmental Dynamics, 235, 1142-1149 (2006)
Kanamoto, T., Terada, K., Yoshikawa, H., Furukawa, T.
Cloning and expression pattern of lbx3, a novel chick homeobox gene.
Mechanisms of Development/Gene Expression Patterns, 6. 241-246 (2006)
Koike, C., Nishida, A., Akimoto K., Nakaya, M., Noda, T., Ohno, S., Furukawa, T.
Function of aPKCl in differentiating photoreceptors is required for proper lamination of mouse retina.
J. of Neurosci., 25, 10290-10298 (2005)
Saito, H., Tsumura, H., Otake, S., Nishida, A., Furukawa, T., Suzuki N.
L7/Pcp-2-specific expression of Cre recombinase using knock-in approach.
BBRC, 331, 1216-1221 (2005)
Morrow, E.M., Furukawa, T., Raviola, E., Cepko, C.L.
Synaptogenesis and outer segment formation are peturbed in the neural retina.
BMC Neuroscience, 6, 1471-2205 (2005)
Nishida, A., Furukawa, A., Koike, C., Tano, Y., Aizawa, S., Matsuo, I., Furukawa, T.
Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal gland development.
Nature Neurosci., 6, 1255-1263 (2003)
論文解説③
Furukawa, A., Koike, C., Lippincott, P., Cepko, C.L., Furukawa, T.
The mouse Crx 5’ upstream transgene sequence directs a cell-specific and developmentally regulated expression in retinal photoreceptor cells.
J. of Neurosci., 22,1640-1647 (2002)
Blackshaw, S., Fraioli, R.E., Furukawa, T., Cepko, C.L.
Comprehensive Analysis of Photoreceptor Gene Expression and the Identification of Candidate Retinal disease Genes.
Cell, 107, 579-589 (2001)
Furukawa,T., Shiddartha, M., Bao, Z-Z, Morrow, E.M., Cepko, C.L.
rax, Hes1 and Notch1 promote the formation of Muller glia by postnatal retinal progenitor cells.
Neuron, 26, 383-394 (2000)
Livesey, F.J. Furukawa, T., Steffen, M., Church, G.M., Cepko, C.L
Microarray anaysis of the transcriptional netwaork controlled by the photoreceptor-specific homeobox gene Crx.
Curr Biol, 10, 301-310 (2000)
*Furukawa, T., Morrow, E.M., Li, T., Davis, F.C., *Cepko, C.L.
Retinopathy and attenuated circadian entrainment in Crx-deficient mice.
Nature Genet., 23, 466-470 (1999)
(*Corresponding author)
*Schulte, D., *Furukawa, T., *Peters, M.A., Kozak, C.A., Cepko, C.L. Misexpression of the Emx-related homeobox genes cVax and mVax2 ventralizes the retina and perturbs the retinotectal map.
Neuron, 24, 541-553 (1999)
(*First three authors contributed equally to this work.)
Morrow, E.M., Furukawa, T., Lee. J.E., Cepko, C.L.
Neuro D regulates cell fate determination in the Developing neural retina.
Development, 126, 23-36 (1999)
Morrow, E.M., Furukawa, T., Cepko, C.L.
Vertebrate photoreceptor cell development and disease.
Trends in Cell Biol., 8, 353-358 (1998)
Taniguchi, Y., Furukawa, T., Tun, T., Han, H., Honjo, T.
LIM protein KyoT2 negatively regulates transcription by association with the RBP-JDNA-binding protein.
Mol Cell Biol., 18, 644-654 (1998)
Furukawa, T., Morrow, E.M., Cepko, C.L.
Crx, a novel otx-like homeobox gene, shows photoreceptor-specific expression and regulates photoreceptor differentiation.
Cell, 91, 531-541 (1997)
*Freund, C.L., *Gregory-Evans, C.Y., *Furukawa, T., Papaioa
論文解説⑥
Samd7 is a cell type-specific PRC1 component essential for establishing retinal rod photoreceptor identity. Proc Natl Acad Sci U S A. 2017.Omori Y, Kubo S, Kon T, Furuhashi M, Narita H, Kominami T, Ueno A, Tsutsumi R, Chaya T, Yamamoto H, Suetake I, Ueno S, Koseki H, Nakagawa A and Furukawa T
Proc Natl Acad Sci U S A. 2017.
<研究成果のポイント>
・網膜の視細胞のアイデンティティーがエピジェネティックに制御されていることを発見。
・脳や網膜の神経細胞の終末分化がエピジェネティックに制御されているかどうかは、これまであまりよく分かっていなかった。
・夜盲などの網膜の機能低下のメカニズム解明や網膜再生医療研究の基盤となる成果。
<概要>
大阪大学蛋白質研究所の大森義裕准教授、久保竣(大学院生)及び古川貴久教授の研究チームは、名古屋大学、理化学研究所との共同研究で、眼の網膜にある光センサー細胞(網膜視細胞)におけるエピジェネティックな制御の仕組みを解明し、神経発生における重要性を明らかにしました。
脳や網膜の神経細胞の終末分化がエピジェネティックに制御されているかどうかは、これまであまりよく分かっていませんでした。そこで、大森准教授らの研究グループは、桿体(かんたい)視細胞に発現するSamd7(サムディーセブン)という蛋白質が、その構造からエピジェネティックな制御に関わっている可能性があると注目しました。Samd7のノックアウトマウスを作製し解析したところ、Samd7ノックアウトマウスの眼の網膜では、本来、桿体視細胞ではまったく発現しない青色オプシンが強く発現しており、逆に、もとから桿体視細胞にある桿体オプシンの量が半減していることがわかりました(図1)。

図1
Samd7欠損マウスでは桿体視細胞のアイデンティティーが変化し視細胞の機能が低下する。Samd7欠損マウスの眼の光センサー細胞(桿体視細胞)では青色オプシンが異常に存在し、桿体オプシンが半減し、視細胞の機能が低下する。Samd7がオプシンのエピジェネティックな制御を行うことを発見した。
神経細胞のアイデンティティー形成にエピジェネティック制御が重要であることがノックアウトマウスを用いた研究で明らかとなりました。この成果は、網膜視細胞や神経細胞のアイデンティティー形成の仕組みを理解する上で大きな前進となるものです。 本研究成果は、2017年9月12日(火)午前4時(日本時間)に科学誌「米国アカデミー紀要 Proceedings of the National Academy of Sciences of the United States of America(PNAS)」に公開されました。
<研究の背景>
ヒトを含む脊椎動物の眼の網膜には視細胞と呼ばれる光センサー細胞があります。ヒトの場合、赤色・青色・緑色の色を見分ける錐体視細胞と、明暗を見分ける桿体視細胞があります。発生過程において、赤色・青色・緑色の錐体視細胞と桿体視細胞のそれぞれには波長特性が異なるオプシン※1と呼ばれる光センサーたんぱく質が発現して最終的な細胞分化が完成することが知られています。例えば、赤色錐体視細胞には赤色オプシンのみが発現し、桿体視細胞には桿体オプシンのみが発現します。オプシン以外にも、錐体視細胞と桿体視細胞ではそれぞれ錐体型、桿体型の多くの異なる光受容たんぱく質が発現していますが、このような視細胞のアイデンティティーを確立する仕組みは十分に解明されていませんでした。
<研究の内容>
今回、大森准教授らの研究グループは、桿体視細胞においてオプシンをはじめとする様々な遺伝子がエピジェネティックな制御を受けて視細胞のアイデンティティーを確立することを明らかにしました。
エピジェネティック制御とはDNAの配列変化によらない遺伝子発現の制御・伝達機構のことで、多細胞生物の発生・分化や癌、精神疾患など疾患発症とも深い関わりがあり、近年、環境と生物の関わりを制御する仕組みとして注目されています。
本研究において、大森准教授らの研究グループは、桿体視細胞に発現するSamd7(サムディーセブン)という蛋白質が、その構造からエピジェネティックな制御に関わっている可能性があると注目しました。Samd7のノックアウトマウスを作製し解析したところ、Samd7ノックアウトマウスの眼の網膜では、本来、桿体視細胞ではまったく発現しない青色オプシンが強く発現しており(図2)、逆に、もとから桿体視細胞にある桿体オプシンの量が半減していることがわかりました。そのため、Samd7ノックアウトマウスでは桿体視細胞の機能が低下していることが明らかとなりました(図3)。ヒトでは夜盲と呼ばれる暗い場所で物が見えにくくなる視覚障害が知られていますが、Samd7ノックアウトマウスは夜盲に近い症状をもつと考えられます。
Samd7と結合する蛋白質の探索から、ポリコーム抑制複合体※2と呼ばれるエピジェネティックな制御因子がSamd7と結合することがわかりました。Samd7はポリコーム抑制複合体を介して、ヒストンのメチル化とユビキチン化を制御し、青色オプシンの他にも少なくとも約400個の遺伝子を制御していることがわかり、Samd7が桿体視細胞のアイデンティティーの確立に必須の役割を果たすことが証明されました(図4)。

図2
Samd7欠損マウスでは青色オプシンが桿体視細胞に異常に発現する。野生型およびSamd7欠損マウスの視細胞に存在する青色オプシン蛋白質を蛍光で染色した。野生型では錐体視細胞にしか存在しない青色オプシンがSamd7欠損マウスでは桿体視細胞においても異常に発現することが確認された。

図3
Samd7 欠損マウスでは視細胞の機能が低下する。マウスに暗闇の中で光を当て、その電気的反応を記録した(網膜電図)。Samd7欠損マウスでは神経細胞の反応が弱く視細胞の機能が低下していることがわかる。

図4
Samd7は桿体視細胞においてエピジェネティックな遺伝子制御を行うSamd7が青色オプシン遺伝子を制御する仕組み。Samd7は桿体視細胞の核の中でポリコーム抑制複合体(エピジェネティック因子)と結合し、染色体上のDNAを巻き付けているヒストンと呼ばれる蛋白質を修飾することで青色オプシンの遺伝子のスイッチをOFFにする役割を持つことが解明された。
今回の成果は、今まで明らかでなかった桿体視細胞のエピジェネティックな遺伝子制御機構を解明したことによって、視細胞のアイデンティティー確立の仕組みの理解につながるものです。視細胞分化のメカニズムをエピジェネティックな観点から解明した初めての研究であり、夜盲などの網膜の機能低下のメカニズム解明や網膜再生医療研究の基盤となると考えられます。
<用語説明>
※1 オプシン
青色錐体視細胞には青色オプシン、赤色錐体視細胞には赤色オプシン、緑色錐体視細胞には緑色オプシン、桿体視細胞には桿体オプシンのみが発現しており、これらのオプシンの発現は厳密に制御されている。
※2 ポリコーム抑制複合体
ポリコーム抑制複合体RC(polycomb repressive complex)は2つの複合体PRC1,PRC2から成り、ヒストンのメチル化やユビキチン化といったヒストン修飾を制御することで、遺伝子発現の制御を行うエピジェネティック因子である。
論文解説⑤
Versatile functional roles of horizontal cells in the retinal circuitTaro Chaya, Akihiro Matsumoto, Yuko Sugita, Satoshi Watanabe, Ryusuke Kuwahara, Masao Tachibana, Takahisa Furukawa
Sci Rep. 2017 Jul 17;7(1):5540.
<研究成果のポイント>
◆ 網膜において最も数の少ない細胞種(水平細胞)が、視覚に重要な役割を果たすことを発見した。
◆ これまで水平細胞が個体レベルの視覚にどのように寄与しているかは明らかではなかった。
◆ 失明に対する、再生医療をはじめとした視覚再建法の開発に向けた基盤となる知見と考えられる。
<概要>
大阪大学蛋白質研究所の古川貴久教授、東京大学大学院人文社会系研究科の立花政夫名誉教授らの研究グループは、網膜において最も数が少ない細胞種である水平細胞が、視覚の形成に重要な役割を担うことを明らかにしました。
これまで網膜水平細胞について、細胞レベルでの役割は詳細に解析されてきましたが、網膜の神経回路(図1)レベルの機能についてはあまり理解が進んでおらず、個体の視覚にどのように寄与するのかは不明でした。
今回、古川教授らの研究グループは、網膜において水平細胞を選択的に欠失させることができるマウスモデルの作製に成功し、このマウスの視覚機能を解析することにより、水平細胞が多様な側面から視覚に重要な役割を担っていることを解明しました。本研究は、網膜における視覚情報の処理メカニズムの理解を推し進めるだけでなく、網膜色素変性症などによる失明に対する、再生医療をはじめとした視覚再建法の開発に向けた基盤となる知見をもたらすと考えられます。
本研究成果は、英国科学誌「Scientific Reports」に、7月17日(月)に公開されました。

図1 網膜神経回路の模式図
視細胞が受け取った光情報は電気信号に変換され、網膜神経回路を経て最終的に脳へと伝達される。この伝達の過程における水平細胞の役割はあまり明らかではなかった。網膜は眼球の後方に位置する神経組織であり、主に5種類の神経細胞から構成され、これらの神経細胞により神経回路が構築されています(図1)。網膜において外界の光情報は電気信号へと変換され、この神経回路を経て脳へと伝達されます。このうち水平細胞は、光を受容する視細胞、視細胞からのシグナルを受け取る双極細胞の2種類の神経細胞と接続する、網膜において最も数が少ない細胞種です。 水平細胞についてはこれまで主に阻害剤等を用いた薬理学的手法により、細胞レベルでの機能メカニズムは詳細に解明されてきました。しかしながら、水平細胞の神経回路レベルでの機能についてはあまり理解が進んでおらず、個体の視覚にどのように寄与するのかは明らかになっていませんでした。
<研究の内容>
古川教授らの研究グループは、網膜から選択的に水平細胞を欠失させることができるマウスモデルを作製しました。このマウスの視覚機能を調べた結果、水平細胞は視覚情報の処理において多様な側面で関与していることが明らかになりました。 具体的には水平細胞欠損マウスにおいて、 1)網膜の出力細胞である神経節細胞の発火を引き起こすことができる光刺激の領域(受容野)が拡大しました。
2)光に対する神経節細胞ごとに異なる応答の多様性が減少しました。
3)神経節細胞の周囲の光強度に応じた応答の順応(明順応)が低減しました。
4)個体レベルでの視覚感度の上昇が観察されました。
以上より、水平細胞はこれまで知られていた受容野の形成のみならず、神経節細胞の機能的な多様性や明順応、視覚感度の調節に重要な役割を果たしていることが明らかになりました。
<本研究成果が社会に与える影響(本研究成果の意義)>
本研究により、網膜における視覚の情報処理メカニズムの理解が進みました。さらに本研究を含め、外界の光情報を網膜がどうようにして脳において適切に読み解けるように処理しているのかを明らかにすることは、網膜色素変性症等による失明に対する視覚再建を実際の視覚により近いレベルで達成する足掛かりとなることが期待されます。
論文解説④
Ick ciliary kinase is essential for planar cell polarity formation in inner ear hair cells and hearing functionOkamoto S, Chaya T, Omori Y, Kuwahara R, Kubo S, Sakaguchi H and Furukawa T
J. of Neurosci, 2017, Feb 22;37(8): 2073-2085.
<研究の背景>
音の認知は、耳で受容された音が脳へ伝達されることにより行われます。 まず音は外耳・中耳で増幅され、内耳に到達します。内耳では音により生じる振動という機械的刺激が電気信号に変換され、脳へと伝達されます。 この音の伝達経路のいずれかの部位が障害された場合に難聴となり、外耳もしくは中耳に障害がある場合は伝音難聴、内耳に障害がある場合は感音難聴と呼ばれます。 先天性難聴は出生数約1000人に1人の割合で起こるとされ、この多くは感音難聴であることが知られています。また先天性難聴の約半数は遺伝性難聴であることが報告されています。 一方、繊毛症と呼ばれる、繊毛の機能異常により引き起こされる遺伝性疾患の中に、感音難聴を伴うものがあります。 繊毛は細胞表面より突出する構造物であり、運動機能を持つものや、細胞外シグナルを受容する感覚器としての機能を持つものがあります。 また繊毛は全身の臓器で重要な役割を果たしており、内耳においても繊毛を構成する蛋白質が発生期において機能していることが知られています。 しかし、このような繊毛蛋白質の機能を制御している酵素が内耳においてどのような役割を果たしているか、ということは明らかにされていませんでした。
<研究内容>
当研究グループは以前、リン酸化酵素のIntestinal cell kinase (ICK)が繊毛内の蛋白質輸送に必須であることを明らかにしていました。 今回、京都府立医科大学耳鼻咽喉科・頭頸部外科学教室の岡本志央医師ならびに坂口博史准教授との共同研究で、ICKがマウスの内耳にも発現していることを見出しました。 内耳における音の受容器官である蝸牛の有毛細胞頂面の構造は非対称となっています。有毛細胞の頂面には不動毛と呼ばれる感覚毛がV字型もしくは弧状に配列しています。 また発生期にはV字または弧の頂点に1本の動毛と呼ばれる繊毛が存在していますが、発生が進むにつれて退縮し、成体では消失します。 不動毛は動毛に隣接する部位で最も長く、動毛から離れるほど短くなる階段状に並んでいます。平面内細胞極性と呼ばれるこの非対称性こそが聴覚にとって重要であることが知られています 。また有毛細胞と有毛細胞の間には支持細胞があり、支持細胞の頂面にも繊毛が存在しています。 ICK欠損マウスの蝸牛有毛細胞では不動毛の配列や動毛の位置に異常が見られ、平面内細胞極性が障害されていると考えられました。 また繊毛内輸送に関わる蛋白質であるIFT88が動毛の先端に集積していました。また支持細胞の繊毛においてもIFT88が先端に集積しており、さらに繊毛は伸長していました。 全身でICKを欠損させたマウスは胎生致死となるため、ICKを内耳特異的に欠損させたところ、生直後において、全身における欠損マウスと同様に有毛細胞における平面内細胞極性の障害や、支持細胞の繊毛の伸長が見られました。ICKを内耳特異的に欠損させた成体マウスにおいては難聴が認められました。 また聴覚が障害される周波数と平面内細胞極性の障害部位は一致しており、平面内細胞極性の障害により難聴が引き起こされると考えらえました。 これらの結果よりICKは内耳において繊毛形成と蝸牛有毛細胞の平面内細胞極性を制御することにより、聴覚機能において重要な役割を果たしていることが明らかになりました。
論文解説①
Prdm13 Regulates Subtype Specification of Retinal Amacrine Interneurons and Modulates Visual Sensitivity.Watanabe S, Sanuki R, Sugita Y, imai W, Yamazaki R, Kozuka T, Ohsuga M, Furukawa T.
J. of Neurosci, 2015, May 20;35(20): 8004-20.
Prdm13は網膜アマクリン細胞のサブタイプ分化と視覚感度を制御する
〜Prdm13欠損マウスでは視覚応答感度が上昇する!〜
近年、中枢神経系におけるインターニューロン(介在神経細胞)が果たす役割が注目されている。インターニューロンは、局所の神経回路で神経細胞の活動を調節し、多様なサブタイプが存在する。大脳皮質のインターニューロンの機能障害は、てんかん、自閉症、統合失調症などの精神神経疾患に関連することが知られており、インターニューロンのサブタイプ分化機構や生理機能に関する研究は、神経科学および医学において非常に重要なテーマとなっている。
今回、私たちは網膜のインターニューロンであるアマクリン細胞の一部に転写因子Prdm13が特異的に発現していることを見出した。Prdm13を発現する細胞の多くはGABAやグリシンを神経伝達物質とする抑制性神経細胞であった。Prdm13欠損マウスを作製したところ、アマクリン細胞の約3割が消失した。またPrdm13を発生期の網膜に強制発現するとGABAまたはグリシン作動性アマクリン細胞の分化を強く促進したが、Prdm13はアセチルコリン作動性のアマクリン細胞は誘導しなかったことから、Prdm13が一部のアマクリン細胞の分化に関わることが示唆された。
さらに興味深いことに、Prdm13欠損マウスは視覚刺激に対する応答感度が上昇していた。私たちが知る限り、Prdm13欠損マウスは視覚応答感度が上昇するノックアウトマウスの最初の例である。本研究から、Prdm13が発現するアマクリン細胞は適切な視覚応答感度の調節に重要であることが明らかになった。
omori論文解説②
Negative regulation of ciliary length by ciliary male germ cell-associated kinase (Mak) is required for retinal photoreceptor survival.Omori Y, Chaya T, Katoh K, Kajimura N, Sato S, Muraoka K, Ueno S, Koyasu T, Kondo M, Furukawa T. Proc Natl Acad Sci U S A. 2010 Dec 8
「繊毛キナーゼMakによる繊毛の長さ制御は網膜視細胞の生存に必須である」
網膜色素変性症は、眼の網膜に存在する視細胞が、変性することにより、視覚障害を引き起こす疾患であるが、その根本的な治療法は確立されていない。網膜色素変性症の原因遺伝子のひとつにRP1があるが、RP1が網膜色素変性症を引き起こす仕組みは明らかではなかった。眼の網膜では、視細胞と呼ばれる神経細胞が光センサーの役割を果たしている。視細胞には、光センサーの役割を果たす外節が発達する。この外節は、繊毛(cilia)と呼ばれる微小管を軸とした構造がベースとなっている。視細胞の繊毛が正常に作られる仕組みはこれまでよくわかっていなかった。 我々は、マイクロアレイを用いたスクリーニングにより、機能未知キナーゼであるMAKが網膜の視細胞に発現することを見出した。MAK遺伝子を欠損したマウスでは、ヒトの網膜色素変性症に似た症状が見られることを発見した。このマウスでは、生後12カ月までにゆっくりとした視細胞の変性が見られた。このマウスは、光を感知する能力が劣っていることが、電気生理学的な実験からわかった。そこで、網膜の組織を詳細に観察したところ、興味深いことに、このMAK欠損マウスでは、視細胞の繊毛と呼ばれる神経細胞の「アンテナ」の部分が異常に伸びて長くなっていた。更に、分子生物学的な手法により、このMAKが網膜色素変性症の原因遺伝子であるRP1をリン酸化することで、繊毛の長さを調節していることを発見した。この研究は、神経細胞のアンテナである繊毛が「伸びすぎること」が網膜色素変性症の原因となりうることを見出した研究であり、今後の展開が期待される。
論文解説③
Nishida, A., Furukawa, A., Koike, C., Tano, Y., Aizawa, S., Matsuo, I., Furukawa, T. Otx2 homeobox gene controls retinal photoreceptor cell fate and pineal gland development. Nature Neurosci., 6, 1255-1263 (2003)網膜視細胞は錐体・桿体の2種類の細胞からなり、眼球の後方に位置し、哺乳類において唯一の光センサーとして働きます。網膜視細胞は、その解剖学的および臨床的重要性から多くの研究がなされてきましたが、発生メカニズムについてはまだ十分に解明されていませんでした。また、松果体については、体内リズムとの関連について多くの研究がなされてきましたが、その発生メカニズムは不明でした。
我々は以前より網膜視細胞の発生機構を明らかにしようと研究してきました。以前の研究で、我々は網膜視細胞と松果体に特異的に発現する転写因子Crxを単離し、いくつかの網膜変性疾患の原因遺伝子であることを明らかにしました。その後、ノックアウトマウスの解析により、Crxが視細胞における光受容反応および松果体におけるメラトニン合成に重要であることを示しました。しかしながら、Crxのホモ接合ノックアウトマウスにおいても視細胞の初期発生がみられることから、Crxと機能的に重複する遺伝子の存在が示唆されていました。そこで今回、Crxと同じOtxファミリーに属し、網膜における発現が報告されているOtx2に注目しました。Otx2はショウジョウバエの遺伝子orthodenticleの哺乳類におけるホモログとしてクローニングされ、前脳、中脳、松果体、神経網膜、網膜色素上皮といった組織における発現が報告されています。我々は最近の研究において、視細胞が網膜幹細胞から分化する際の最初の鍵を握る遺伝子がOtx2であることを明らかにしました。
まず、in situ hybridizationによりOtx2の時間的、空間的発現パターンをCrxと比較しました。Otx2の神経網膜における発現はCrxよりもやや先行して発生過程の視細胞にみられましたが、生後網膜では視細胞での発現がほとんどみられなくなりました。次に、Otx2の網膜視細胞発生における役割を調べるために、コンディショナルノックアウトマウスを解析しました。Otx2のホモ接合ノックアウトマウスは胎生致死ですので、Crxプロモーターの制御下に網膜視細胞および松果体において特異的にOtx2の発現が消失するようなコンディショナルノックアウトマウスを作成しました。Otx2コンディショナルノックアウトマウスでは、網膜視細胞の発生はみられず、網膜神経細胞の一種であるアマクリン細胞が著明に増加していました。これは、本来であれば網膜視細胞に分化すべき細胞が、Otx2の機能消失により、アマクリン細胞へと細胞運命を転換したと考えられます。また、松果体は完全に欠損していました。Otx2コンディショナルノックアウトマウスの網膜における各種転写因子の発現を調べたところ、Crxの発現が著しく低下していました。また、レトロウィルスベクターを用いてラットの網膜未分化前駆細胞にOtx2を強制発現させると、アマクリン細胞、双極細胞、ミューラー細胞への分化が抑制され、視細胞への分化が促進ました。さらに、Crxのプロモーター領域を用いてルシフェラーゼアッセイを行い、Otx2がCrxプロモーター上のOTX結合部位を介してCrxの発現を制御することを示唆するデータが得られました。これらの結果から、Otx2は網膜視細胞の運命決定に必要かつ十分であり、またCrxの上流遺伝子として働くことが示されました。
この研究で、Otx2が網膜視細胞および松果体の初期発生を制御する最上流に位置する遺伝子であることが明らかになりました。今後、網膜幹細胞や神経幹細胞にOtx2を導入することにより、視細胞への分化誘導が可能になると期待されます。この研究は、現在の医学では治療の方法がない難治性網膜疾患の治療につながる研究であると考えられます。
