<研究テーマ>
1. 選択的シナプス形成の分子機構の解析
2. 神経細胞分化に関わる転写因子・エピジェネティックスの解析
3. マイクロRNA(miRNA)による中枢神経系の制御メカニズムの解析
4. 細胞のアンテナである繊毛(cilia)の形成と神経系における機能の解析
5. 遺伝子改変マウスの作製と視覚機能の解析
研究の方法論としては、当研究室が得意とする分子生物学的手法による重要な遺伝子の単離、一細胞遺伝子発現解析、ゲノム編集による遺伝子改変マウスの作製、組織学的解析 (in situハイブリダイゼーションや免疫染色など)、生化学的解析、電気生理学的解析、個体レベルでの視機能アッセイなどを用いています。遺伝子・タンパク質から細胞、組織、個体の各レベルでの解析を自在に行き来する研究方法で、「in vivoでの機能を見る」研究を重視しています。
1. 選択的シナプス形成の分子機構の解析
近年の様々な研究によって、神経細胞の軸索がどのように標的に向かい伸張していくのかというメカニズムは比較的理解が進んできましたが、特定の神経細胞との選択的なシナプス結合の分子機構はまだよく分かっていません。
私たちは、新規細胞外マトリックス(ECM)タンパク質ピカチュリンを単離し、ピカチュリンがジストログリカンと結合することによって、視細胞—双極細胞間のシナプス形成分子として機能することを見出しました1-4。次に、膜タンパク質Lrit1が明所での視覚を担う錐体視細胞とそれに接続する錐体双極細胞のシナプス形成を制御することを明らかにしました5。また、視細胞-双極細胞間シナプス形成の位置を制御するメカニズムを解明しました6。さらにON型双極細胞の伝達チャネルとしてTRPM1を同定し、その変異がヒトの先天性夜盲の原因となることも明らかにしました7-9。
意外にも、網膜でもシナプス形成や神経回路形成のメカニズムは良く分かっていませんでした。私たちはピカチュリンを突破口として、選択的シナプス形成や神経回路形成の解明を進めようとしています。
論文
1. Nat Neurosci 11(8):923-931, 2008.
2. J Biol Chem 285(41):31208-31216, 2010.
3. J Neurosci 32(18):6126-6137, 2012.
4. Cell Rep 25(1):130-145, 2018.
5. Cell Rep 2(13):3548-3561, 2018.
6. Cell Rep 10(5):796–808, 2015.
7. Proc Natl Acad Sci USA 107(1):332-337, 2010.
8. PLoS ONE 6(5):e19911, 2011.
9. J Neurosci 37(41)9889-9900, 2017.
総説
Cell Mol Life Sci. 77(7):1251-1266, 2020
私たちは、新規細胞外マトリックス(ECM)タンパク質ピカチュリンを単離し、ピカチュリンがジストログリカンと結合することによって、視細胞—双極細胞間のシナプス形成分子として機能することを見出しました1-4。次に、膜タンパク質Lrit1が明所での視覚を担う錐体視細胞とそれに接続する錐体双極細胞のシナプス形成を制御することを明らかにしました5。また、視細胞-双極細胞間シナプス形成の位置を制御するメカニズムを解明しました6。さらにON型双極細胞の伝達チャネルとしてTRPM1を同定し、その変異がヒトの先天性夜盲の原因となることも明らかにしました7-9。
意外にも、網膜でもシナプス形成や神経回路形成のメカニズムは良く分かっていませんでした。私たちはピカチュリンを突破口として、選択的シナプス形成や神経回路形成の解明を進めようとしています。
論文
1. Nat Neurosci 11(8):923-931, 2008.
2. J Biol Chem 285(41):31208-31216, 2010.
3. J Neurosci 32(18):6126-6137, 2012.
4. Cell Rep 25(1):130-145, 2018.
5. Cell Rep 2(13):3548-3561, 2018.
6. Cell Rep 10(5):796–808, 2015.
7. Proc Natl Acad Sci USA 107(1):332-337, 2010.
8. PLoS ONE 6(5):e19911, 2011.
9. J Neurosci 37(41)9889-9900, 2017.
総説
Cell Mol Life Sci. 77(7):1251-1266, 2020
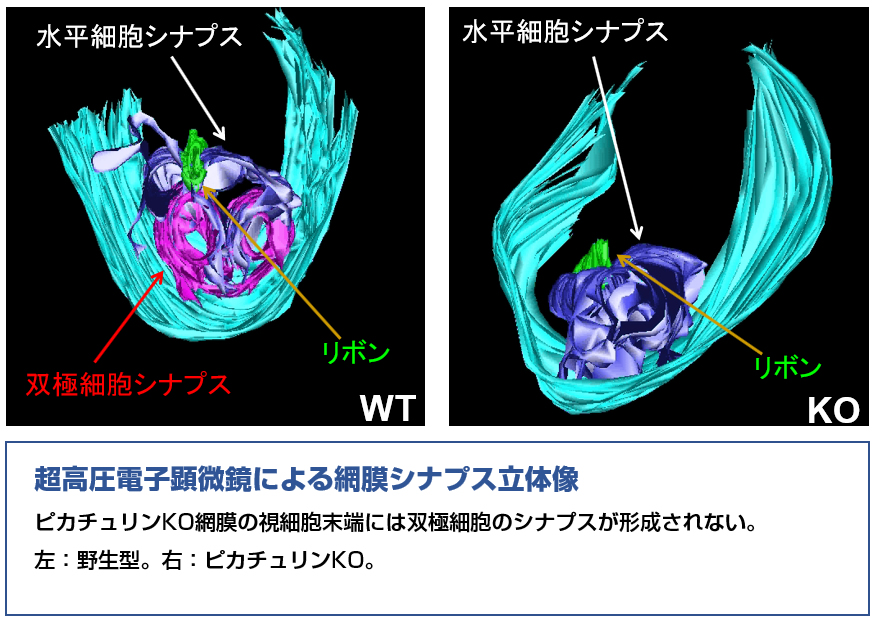
2. 神経細胞分化に関わる転写因子・エピジェネティックスの解析
我々の中枢神経系に存在する1000億個以上と言われる膨大な数の神経細胞の細胞運命はどのように正しく決定されるのでしょうか?そして、その細胞運命の制御はどのようにDNA上にプログラムされているのでしょうか?エピジェネティックな要素やクロマチンの構造はそこにどのように貢献しているのでしょうか? 私たちは網膜の光を受け取る神経細胞である視細胞に注目し、視細胞が前駆細胞からどのように運命決定され、分化してくるのかを転写制御の観点から明らかにしてきました。その中で、転写因子Otx2が視細胞の運命を決定するマスター因子であることや1、転写因子Crxが視細胞の分化と成熟をつかさどるマスター因子であることを発見しました2-5。また、網膜発生のマスター遺伝子Raxを同定し6、Raxが発生後期にはグリア細胞の分化7や視細胞の成熟8をつかさどることも明らかにしてきました。最近では、網膜神経細胞分化のアイデンティティ形成に、エピジェネティックな機構が重要な役割を果たしていることを見出しています9,10。
私たちは視細胞を中心とした神経細胞の発生に関わる分子の網羅的同定を進めており、その中から神経細胞の分化に関わる転写因子を同定し、ノックアウトマウス、コンディショナルノックアウトマウスの作製と解析を精力的に行って、視細胞の運命決定から最終分化までのメカニズムの全貌を生体レベル(in vivo)で明らかにすることを目指しています11-14。
論文
1. Nat Neurosci 6(12): 1255-1263, 2003.
2. Cell 91(4):531-541, 1997.
3. Cell 91(4):543-553, 1997.
4. Nat Genet 23(4):466-470, 1999.
5. Cell Rep 30(3):658-671.e5, 2020.
6. Proc Natl Acad Sci USA 94(7):3088-3093,1997.
7. Neuron 26(2):383-394, 2000.
8. Mol Cell Biol 35(14):2583-2596, 2015.
9. Proc Natl Acad Sci USA 114 (39):E8264-E8273, 2017.
10. J Neurosci 32(49):17658-17670, 2012.
11. Mol Cell Biol 27(23):8318-8329. 2007.
12. J Neurosci 30(19):6515-6526, 2010.
13. J Neurosci 31(46):16792-16807, 2011.
14. J Neurosci 35(20):8004-8020, 2015.
15. J Biol Chem 299(12):105461, 2023.
私たちは視細胞を中心とした神経細胞の発生に関わる分子の網羅的同定を進めており、その中から神経細胞の分化に関わる転写因子を同定し、ノックアウトマウス、コンディショナルノックアウトマウスの作製と解析を精力的に行って、視細胞の運命決定から最終分化までのメカニズムの全貌を生体レベル(in vivo)で明らかにすることを目指しています11-14。
論文
1. Nat Neurosci 6(12): 1255-1263, 2003.
2. Cell 91(4):531-541, 1997.
3. Cell 91(4):543-553, 1997.
4. Nat Genet 23(4):466-470, 1999.
5. Cell Rep 30(3):658-671.e5, 2020.
6. Proc Natl Acad Sci USA 94(7):3088-3093,1997.
7. Neuron 26(2):383-394, 2000.
8. Mol Cell Biol 35(14):2583-2596, 2015.
9. Proc Natl Acad Sci USA 114 (39):E8264-E8273, 2017.
10. J Neurosci 32(49):17658-17670, 2012.
11. Mol Cell Biol 27(23):8318-8329. 2007.
12. J Neurosci 30(19):6515-6526, 2010.
13. J Neurosci 31(46):16792-16807, 2011.
14. J Neurosci 35(20):8004-8020, 2015.
15. J Biol Chem 299(12):105461, 2023.
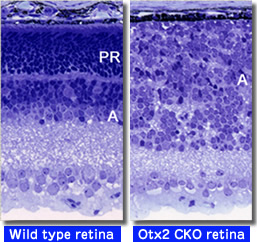

3. マイクロRNA(miRNA)による中枢神経系の制御メカニズムの解析
近年、様々な生物種で、18-25塩基程度の小さなRNA、マイクロRNA(miRNA)が数多く転写されていることがわかってきました。マイクロRNAは相補的な配列をもつターゲット遺伝子の発現を抑制し、発生、分化、代謝、発がんなどの様々な生体現象に関わっていると考えられています。
私たちは中枢神経特異的な発現を示すマイクロRNA-124a(miR-124a)が海馬の正常な神経回路形成や網膜錐体細胞の生存に必須であることを明らかにしました1。私たちは中枢神経系に発現するマイクロRNA群が重要な機能を担っていると注目しており、マイクロRNAの生体機能や作用機構を解明することによって、中枢神経系の新たな遺伝子制御機構を明らかにしたいと考えています2。
論文
1. Nat Neurosci 14(9): 1125-1134, 2011.
2. Sci Rep 9(1):3445, 2019.
3. J Biol Chem 298(9):102293, 2022.
私たちは中枢神経特異的な発現を示すマイクロRNA-124a(miR-124a)が海馬の正常な神経回路形成や網膜錐体細胞の生存に必須であることを明らかにしました1。私たちは中枢神経系に発現するマイクロRNA群が重要な機能を担っていると注目しており、マイクロRNAの生体機能や作用機構を解明することによって、中枢神経系の新たな遺伝子制御機構を明らかにしたいと考えています2。
論文
1. Nat Neurosci 14(9): 1125-1134, 2011.
2. Sci Rep 9(1):3445, 2019.
3. J Biol Chem 298(9):102293, 2022.
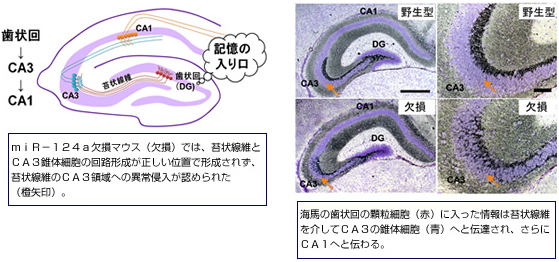
4. 細胞のアンテナである繊毛(cilia)の形成と神経系における機能の解析
網膜では、視細胞と呼ばれる感覚神経細胞がセンサーとなり、光をとらえます。視細胞には、繊毛と呼ばれる微小管でできたアンテナが生えており、光をとらえる分子(オプシン)の輸送に重要な役割を果たしています。この繊毛が壊れると、網膜色素変性症と呼ばれる失明に至る疾患を引き起こすことが知られています。 また、眼以外の組織でも、繊毛の異常は繊毛病とよばれる疾患の原因となることが知られています。繊毛関連遺伝子の異常により、内蔵逆位や、難聴、腎臓病、肥満、多指症、不妊などの繊毛病を引き起こすことがわかってきましたが、その分子機構は未解明な部分が多く、病態メカニズムの解明とそれに基づいた治療法の開発が期待されています。
これまでに私たちは、繊毛の機能解析に適したモデル動物であるゼブラフィッシュを用いて、繊毛におけるタンパク質輸送機構を明らかにしました1,2。また、遺伝子改変マウスを用いて、生体内において機能未知のリン酸化酵素MakとIckが繊毛内におけるタンパク質輸送の制御や繊毛の形成に重要な役割を担い、これらの変異がヒトの繊毛病の原因となることを明らかにしました3-5。さらに、ユビキチン化酵素Klhl18が視細胞の繊毛内におけるタンパク質輸送の調節を介して明暗順応を制御することを明らかにしました6。現在、私たちは、ノックアウトマウスなどを用いて繊毛が機能する仕組みと、繊毛関連疾患が引き起こされるメカニズムを解析しています。
論文
1. Nat Cell Biol 10(4):437-444,2008.
2. J Biol Chem 291(47): 24465-24474, 2016.
3. Proc Natl Acad Sci USA 107(52):22671-22676, 2010.
4. EMBO J 33(11):1227-42, 2014.
5. J Neurosci 37(8):2073-2085, 2017.
6. EMBO J 38, e101409, 2019.
7. J Biol Chem 298(3): 101686, 2022.
これまでに私たちは、繊毛の機能解析に適したモデル動物であるゼブラフィッシュを用いて、繊毛におけるタンパク質輸送機構を明らかにしました1,2。また、遺伝子改変マウスを用いて、生体内において機能未知のリン酸化酵素MakとIckが繊毛内におけるタンパク質輸送の制御や繊毛の形成に重要な役割を担い、これらの変異がヒトの繊毛病の原因となることを明らかにしました3-5。さらに、ユビキチン化酵素Klhl18が視細胞の繊毛内におけるタンパク質輸送の調節を介して明暗順応を制御することを明らかにしました6。現在、私たちは、ノックアウトマウスなどを用いて繊毛が機能する仕組みと、繊毛関連疾患が引き起こされるメカニズムを解析しています。
論文
1. Nat Cell Biol 10(4):437-444,2008.
2. J Biol Chem 291(47): 24465-24474, 2016.
3. Proc Natl Acad Sci USA 107(52):22671-22676, 2010.
4. EMBO J 33(11):1227-42, 2014.
5. J Neurosci 37(8):2073-2085, 2017.
6. EMBO J 38, e101409, 2019.
7. J Biol Chem 298(3): 101686, 2022.
5. 遺伝子改変マウスの作製と視覚機能の解析
私たちの研究室では、研究室内でトンランスジェニックマウス(BACトランスジェニック含む)、ノックアウトマウスの作製を行っています。受精卵の単離、インジェクション、ES細胞の培養・組み換え体のスクリーニング、卵管や子宮への卵戻し、凍結受精卵の作製、CRISPR/Cas9法などのゲノム編集技術といった一連のマウス生体工学的手法を得意としています。 マウス生体工学技術を生かして作製した様々な遺伝子改変マウス(細胞特異的Creマウスなど)は、現在までに世界の多くの研究者に使ってもらっています。
私たちは作製した様々な遺伝子改変マウスを用いて、視機能性反応や網膜電図などの視覚機能の解析や1-6、行動解析などの個体レベルでの高次神経機能解析を行い7,8、遺伝子の生体(in vivo)神経機能や病態メカニズムの解明を行っています。
論文
1. Cell Rep 25(1):130-145, 2018.
2. Eur J Neurosci Feb. 6, 2020.
3. Cell Rep 10(5):796–808, 2015.
4. Sci Rep 8(1):17816, 2018.
5. Sci Rep 7(1):5540, 2017.
6. Eur J Neurosci. 38(6):2823-2831, 2013.
7. Nature Immunol 18(12):1342-1352, 2017.
8. Sci Rep 9(1):3445, 2019.
9. iScience 27(4):109380, 2024.
私たちは作製した様々な遺伝子改変マウスを用いて、視機能性反応や網膜電図などの視覚機能の解析や1-6、行動解析などの個体レベルでの高次神経機能解析を行い7,8、遺伝子の生体(in vivo)神経機能や病態メカニズムの解明を行っています。
論文
1. Cell Rep 25(1):130-145, 2018.
2. Eur J Neurosci Feb. 6, 2020.
3. Cell Rep 10(5):796–808, 2015.
4. Sci Rep 8(1):17816, 2018.
5. Sci Rep 7(1):5540, 2017.
6. Eur J Neurosci. 38(6):2823-2831, 2013.
7. Nature Immunol 18(12):1342-1352, 2017.
8. Sci Rep 9(1):3445, 2019.
9. iScience 27(4):109380, 2024.
トランスジェニック作製のためのマウス受精卵前核へのDNAインジェクション
