中井准教授研究室の研究紹介〜詳細版
生物の科学:遺伝 2016年3月号の表紙を飾りました!自由にダウンロードできます。
総説タイトル:葉緑体のタンパク質輸送機構についてーシアノバクテリアの内共生から始まったユニークな進化


「科研費NEWS」2014年度 Vol.1 に紹介されました!

私たちの Science の論文が 米国 Rebeiz 財団による
葉緑体・光合成関連の年間最優秀論文 Paper of the Year に選ばれました!

私たちの研究が Science 2013年2月1日号に掲載されました!
 Shingo Kikuchi, Jocelyn Bedard, Minako Hirano, Yoshino Hirabayashi, Maya Oishi, Midori Imai, Mai Takase, Toru Ide, Masato Nakai.
Shingo Kikuchi, Jocelyn Bedard, Minako Hirano, Yoshino Hirabayashi, Maya Oishi, Midori Imai, Mai Takase, Toru Ide, Masato Nakai.
Uncovering the Protein Translocon at the Chloroplast Inner Envelope Membrane.
Science 2013 Feb 1;339(6119):571-574.
どなたでも閲覧できます。こちらのページから。
大阪大学最新研究成果としても紹介されています!![]() Tweet
Tweet
葉緑体が機能するには何種類ぐらいの蛋白質が必要?
 植物の葉緑体は、2千種類を超える様々な蛋白質が、その機能に応じて適所に適時に配置されることではじめて、光合成反応など植物にとって必要不可欠な役割を果たす事ができます。モデル植物としてよく研究に使われるシロイヌナズナの全ゲノムには2万数千もの遺伝子がありますので、これら葉緑体外のサイトゾルで合成された多数の蛋白質のおよそ10%が、葉緑体によって正確に
植物の葉緑体は、2千種類を超える様々な蛋白質が、その機能に応じて適所に適時に配置されることではじめて、光合成反応など植物にとって必要不可欠な役割を果たす事ができます。モデル植物としてよく研究に使われるシロイヌナズナの全ゲノムには2万数千もの遺伝子がありますので、これら葉緑体外のサイトゾルで合成された多数の蛋白質のおよそ10%が、葉緑体によって正確に 認識されて運ばれてくることになります。葉緑体は、外包膜・内包膜・チラコイド膜の3種類の膜と、それによって囲まれた膜間部・ストロマ・チラコイド内腔の3種類の可溶性画分の計6種類のコンパートメントから成り立っていますから、葉緑体に運ばれた蛋白質は、さらにこれらのコンパートメントのいずれかに正確に仕分けされ輸送されることになります。
認識されて運ばれてくることになります。葉緑体は、外包膜・内包膜・チラコイド膜の3種類の膜と、それによって囲まれた膜間部・ストロマ・チラコイド内腔の3種類の可溶性画分の計6種類のコンパートメントから成り立っていますから、葉緑体に運ばれた蛋白質は、さらにこれらのコンパートメントのいずれかに正確に仕分けされ輸送されることになります。
葉緑体は2千種類もの蛋白質をどうやってそれぞれが機能すべき場所へ運ぶのか?
それでは、葉緑体は、2千種類以上もの全く異なる蛋白質をどのようにして葉緑体へと導き、またそれらが機能すべきコンパートメントへと送り込むのでしょうか?不思議ですね。これまでの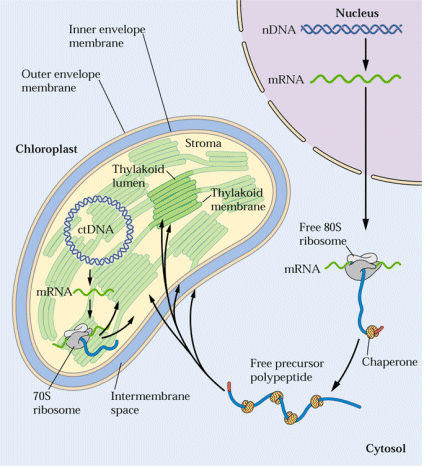 研究から、運ばれる側の葉緑体蛋白質には、トランジット配列という葉緑体に認識されるための配列が、アミノ末端側に付加された状態で合成されることが分かってきました。このトランジット配列が、サイトゾルで合成された後に葉緑体に特異的に輸送されるための荷札となるわけです。さらに、このトランジット配列に続いて、葉緑体内でさらに仕分けられるためのシグナル配列が存在し、その情報に従って適所に配置されることになります。良く出来ていますね。どのようなアミノ酸配列がトランジット配列やシグナル配列として機能できるかも明らかにされつつあります。
研究から、運ばれる側の葉緑体蛋白質には、トランジット配列という葉緑体に認識されるための配列が、アミノ末端側に付加された状態で合成されることが分かってきました。このトランジット配列が、サイトゾルで合成された後に葉緑体に特異的に輸送されるための荷札となるわけです。さらに、このトランジット配列に続いて、葉緑体内でさらに仕分けられるためのシグナル配列が存在し、その情報に従って適所に配置されることになります。良く出来ていますね。どのようなアミノ酸配列がトランジット配列やシグナル配列として機能できるかも明らかにされつつあります。
(from Biochemistry & Molecular Biology of Plants: edited by B.B.Buchanan, W.Gruissem, & R.L. Jones.)
葉緑体の外包膜には1メガダルトンという巨大な輸送複合体が存在しています。
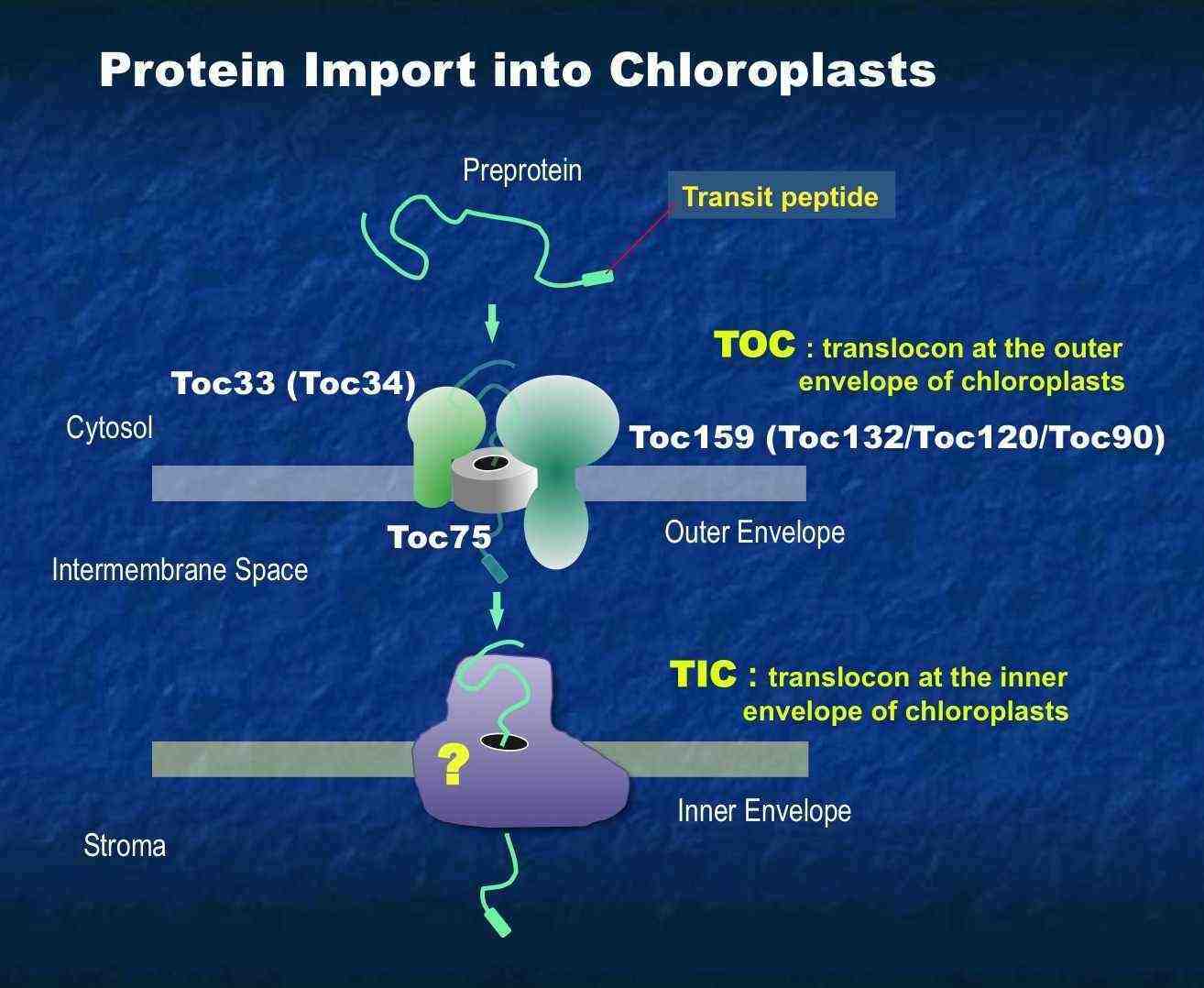 では、運ぶ側の葉緑体の分子メカニズムはどうなっているのでしょうか?これまでの研究から、葉緑体を包む一番外側の膜、すなわち外包膜に葉緑体蛋白質を認識するリセプターと内部へと運ぶ膜透過チャネル複合体(Toc)、内包膜にもストロマへと蛋白質を輸送する膜透過チャネル複合体(Tic)、また、ストロマに運ばれた蛋白質をさらにチラコイドに輸送する際に機能する輸送装置が存在することが分かってきました。この中で、チラコイド膜に存在する輸送装置は、他のバクテリアで見出されていた輸送装置と高い相同性を示し、そのため解析がもっとも進んでいます。
では、運ぶ側の葉緑体の分子メカニズムはどうなっているのでしょうか?これまでの研究から、葉緑体を包む一番外側の膜、すなわち外包膜に葉緑体蛋白質を認識するリセプターと内部へと運ぶ膜透過チャネル複合体(Toc)、内包膜にもストロマへと蛋白質を輸送する膜透過チャネル複合体(Tic)、また、ストロマに運ばれた蛋白質をさらにチラコイドに輸送する際に機能する輸送装置が存在することが分かってきました。この中で、チラコイド膜に存在する輸送装置は、他のバクテリアで見出されていた輸送装置と高い相同性を示し、そのため解析がもっとも進んでいます。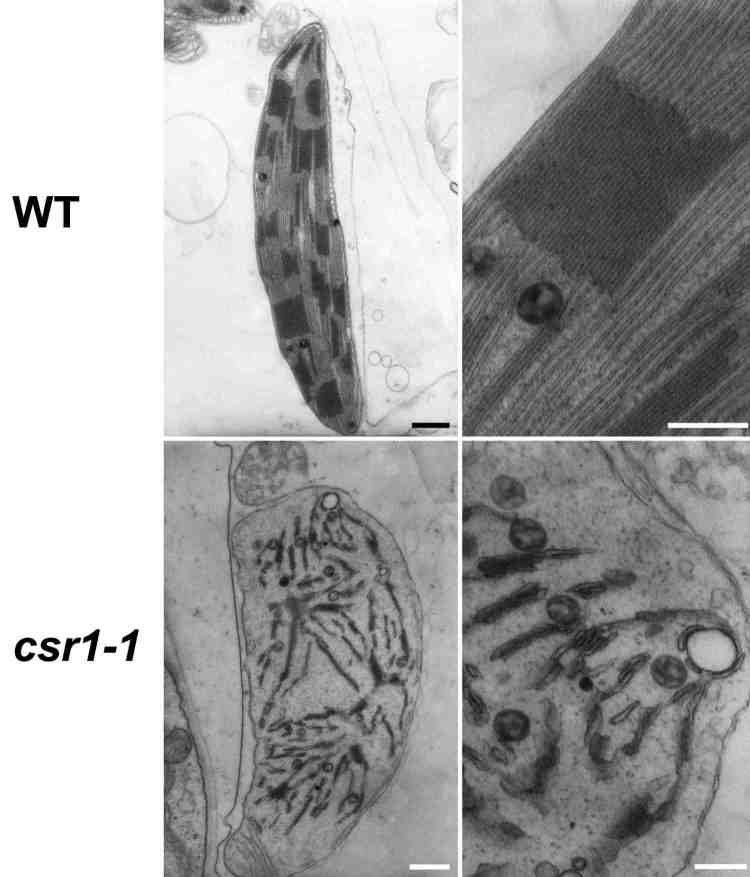 私たちの研究室では、そのキーコンポーネントであるリセプターcpFtsYを世界に先駆けて見出し、その変異体の解析を植物科学のトップジャーナル Plant Cell に発表しています(アメリカオレゴン大Alice Barkan教授グループとの共同研究)。この変異体では、左の電顕写真のように
私たちの研究室では、そのキーコンポーネントであるリセプターcpFtsYを世界に先駆けて見出し、その変異体の解析を植物科学のトップジャーナル Plant Cell に発表しています(アメリカオレゴン大Alice Barkan教授グループとの共同研究)。この変異体では、左の電顕写真のように 野生型に見られる発達したチラコイドは非常に未発達になっています。また、外包膜の輸送装置 Toc に関してもコンポーネントはほぼ定まりつつあり、私たちは、この輸送装置が外包膜中で1メガダルトンという巨大な複合体として存在していることを初めて明らかにしました。
野生型に見られる発達したチラコイドは非常に未発達になっています。また、外包膜の輸送装置 Toc に関してもコンポーネントはほぼ定まりつつあり、私たちは、この輸送装置が外包膜中で1メガダルトンという巨大な複合体として存在していることを初めて明らかにしました。
内包膜を通過途上の葉緑体蛋白質が相互作用する新規な複合体を同定しました!
これらとは対照的に内包膜の輸送装置である Tic については不明の点が数多く残されています。 上の図では、多くのコンポーネントが同定されているように描かれていますが、実は、それぞれが担っている機能や役割分担も明確でなく、中には Tic として働いているのかも不確かなものが含まれています。私たちの研究室では、現在、Tic の全体像を解明するために、内包膜を通過途中の葉緑体蛋白質が相互作用する内包膜の複合体の解析から、そこに含まれる新規因子の同定と、その役割に焦点を当てて研究を進めています。左の写真は私たちが Tic の中心コンポーネントと考えているある蛋白質を欠損する変異シロイヌナズナ(下)で、葉緑体の形成が大きく影響を受けるため、その葉は、ほとんど透き通った形質を示します。
上の図では、多くのコンポーネントが同定されているように描かれていますが、実は、それぞれが担っている機能や役割分担も明確でなく、中には Tic として働いているのかも不確かなものが含まれています。私たちの研究室では、現在、Tic の全体像を解明するために、内包膜を通過途中の葉緑体蛋白質が相互作用する内包膜の複合体の解析から、そこに含まれる新規因子の同定と、その役割に焦点を当てて研究を進めています。左の写真は私たちが Tic の中心コンポーネントと考えているある蛋白質を欠損する変異シロイヌナズナ(下)で、葉緑体の形成が大きく影響を受けるため、その葉は、ほとんど透き通った形質を示します。
葉緑体蛋白質は適所に運ばれるだけではなく機能分子へと変換される必要があります
それでは、葉緑体蛋白質は適所に運ばれるだけでよいのでしょうか?例えば、右の図のチラコイド膜に存在する光化学系Iをご覧下さい(画像をクリックしてみてください。)。
葉緑体内で光化学系Iなどの鉄硫黄クラスターの形成に必須な因子を同定しました!
光化学系Iに含まれている鉄硫黄クラスターですが、 足場蛋白質上の露出した鉄硫黄クラスターの立体構造を初めて明らかにしました!
では、足場蛋白質上の鉄硫黄クラスターはどのような性質を示すのでしょうか?一般に鉄硫黄クラスターは、蛋白質中のシステインというアミノ酸側鎖に配位して組み込まれていますが、 現在、研究に参加してくれる大学院生を募集中ですので、興味ある方は是非研究室見学にお越し下さい!意欲のある方なら、これまでの研究経歴・分野は問いません。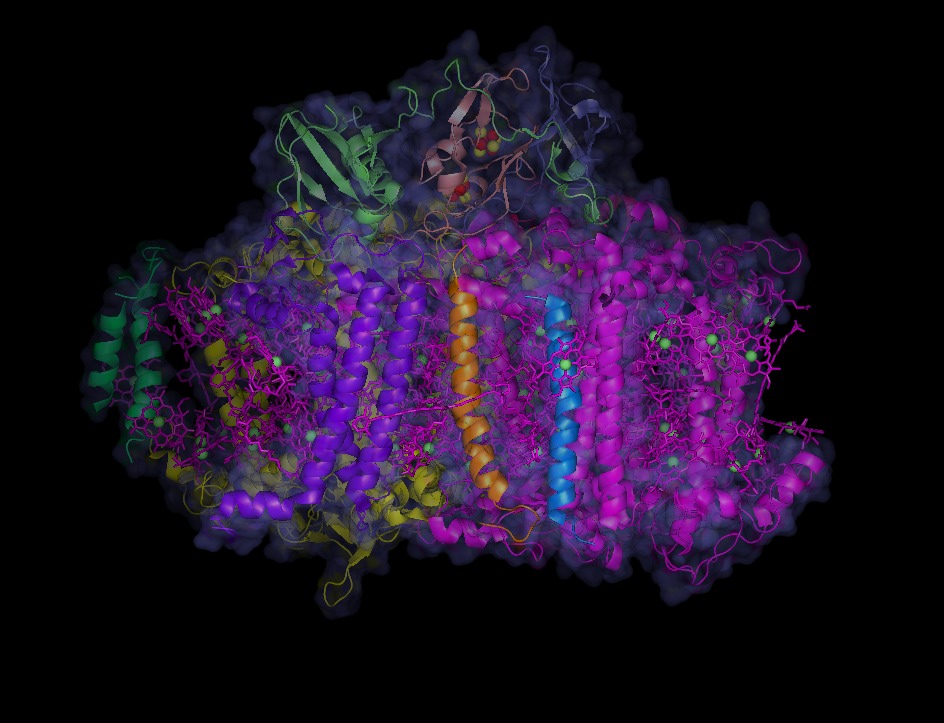 この光合成の中核エンジンといえる複合体は、リボンで示した12種類の蛋白質が正確にアセンブリーすることで作られています。また、ピンクで示した分子は何でしょうか?そうです。クロロフィルです。ランダムに結合しているように見えますが、100近いクロロフィル分子は、決まった位置に意味ある配向性を持って組み込まれていて、光エネルギーを効果的に集め、複合体中心部へと導く働きをします。クロロフィルの上方に浮かぶ黄色と赤のボールで示した低分子が見えますね。これは何でしょう?これは4つの鉄原子と4つの硫黄原子が規則正しく配位した鉄硫黄クラスターというコファクターで、これも特定の蛋白質分子に組み込まれています。これらの鉄硫黄クラスターは、クロロフィルによって集められた光エネルギーによって励起された電子を受け取り、化学エネルギーとして利用する際の電子の運び屋として機能しています。このように、葉緑体に運ばれた蛋白質は、さらに他の蛋白質とアセンブリーしたり、クロロフィルや鉄硫黄クラスターといったコファクターを正確に導入されることで、機能分子へと変換されます。私たちの研究室では、この機能分子変換過程に関与する分子シャペロンや、鉄硫黄クラスター形成因子についても研究を進めています。
この光合成の中核エンジンといえる複合体は、リボンで示した12種類の蛋白質が正確にアセンブリーすることで作られています。また、ピンクで示した分子は何でしょうか?そうです。クロロフィルです。ランダムに結合しているように見えますが、100近いクロロフィル分子は、決まった位置に意味ある配向性を持って組み込まれていて、光エネルギーを効果的に集め、複合体中心部へと導く働きをします。クロロフィルの上方に浮かぶ黄色と赤のボールで示した低分子が見えますね。これは何でしょう?これは4つの鉄原子と4つの硫黄原子が規則正しく配位した鉄硫黄クラスターというコファクターで、これも特定の蛋白質分子に組み込まれています。これらの鉄硫黄クラスターは、クロロフィルによって集められた光エネルギーによって励起された電子を受け取り、化学エネルギーとして利用する際の電子の運び屋として機能しています。このように、葉緑体に運ばれた蛋白質は、さらに他の蛋白質とアセンブリーしたり、クロロフィルや鉄硫黄クラスターといったコファクターを正確に導入されることで、機能分子へと変換されます。私たちの研究室では、この機能分子変換過程に関与する分子シャペロンや、鉄硫黄クラスター形成因子についても研究を進めています。
 その他にもフェレドキシンやb6f複合体のRieske蛋白質など、数多くの葉緑体蛋白質に組み込まれ、必須の役割を果たしています。では、鉄硫黄クラスターはどうやって蛋白質に組み込まれるのでしょうか?
その他にもフェレドキシンやb6f複合体のRieske蛋白質など、数多くの葉緑体蛋白質に組み込まれ、必須の役割を果たしています。では、鉄硫黄クラスターはどうやって蛋白質に組み込まれるのでしょうか? そこには、鉄硫黄クラスタ−を一過的に組み立てる足場蛋白質 Scaffold protein が重要な役割を果たします。この足場蛋白質の上で組み立てられた鉄硫黄クラスターが、様々な蛋白質へと供給されるわけです。私たちの研究室では、CnfUと名付けた蛋白質が、葉緑体内で鉄硫黄クラスタ−生合成の際の足場として重要な役割を果たしており、この蛋白質の機能が低下した葉緑体では、フェレドキシンや光化学系Iの生合成が影響を受けることを初めて見出し、学術誌 Plant Cell に発表しています(現東大 寺島教授グループとの共同研究)。
そこには、鉄硫黄クラスタ−を一過的に組み立てる足場蛋白質 Scaffold protein が重要な役割を果たします。この足場蛋白質の上で組み立てられた鉄硫黄クラスターが、様々な蛋白質へと供給されるわけです。私たちの研究室では、CnfUと名付けた蛋白質が、葉緑体内で鉄硫黄クラスタ−生合成の際の足場として重要な役割を果たしており、この蛋白質の機能が低下した葉緑体では、フェレドキシンや光化学系Iの生合成が影響を受けることを初めて見出し、学術誌 Plant Cell に発表しています(現東大 寺島教授グループとの共同研究)。
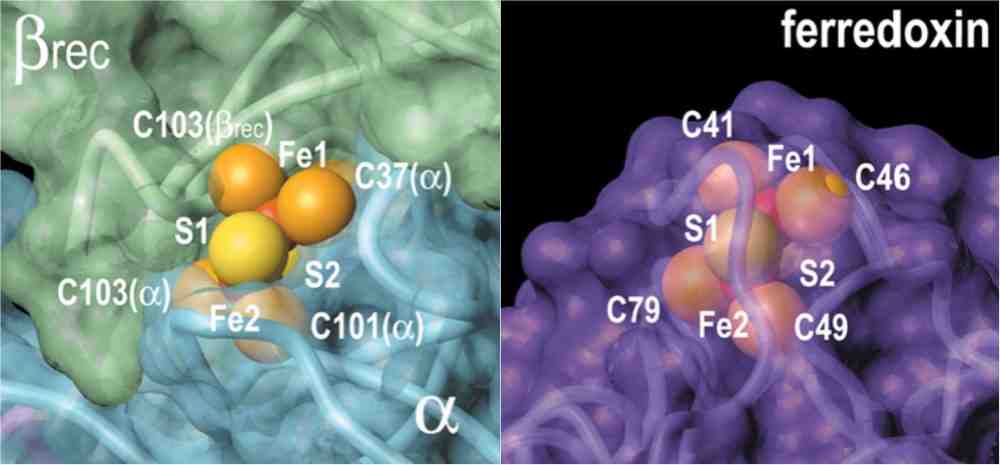 この配位結合はそれほど強くはなく、そのため、鉄硫黄クラスター自身は蛋白質の内部に埋もれ、その周りを蛋白質分子に保護された状態で存在します。これに対して、足場蛋白質上では、鉄硫黄クラスタ−が一過的に組み立てられ、
この配位結合はそれほど強くはなく、そのため、鉄硫黄クラスター自身は蛋白質の内部に埋もれ、その周りを蛋白質分子に保護された状態で存在します。これに対して、足場蛋白質上では、鉄硫黄クラスタ−が一過的に組み立てられ、 さらに、別の蛋白質へと受け渡されなければならないため、その鉄硫黄クラスターの結合様式に大変興味が持たれていました。私たちの研究室では、蛋白研山下博士・月原教授グループとの共同研究で、IscA という足場蛋白質に結合した鉄硫黄クラスターの立体構造を世界に先駆けて決定し Journal of Molecular Biology に報告しています。明らかになった構造では(上図左側)、鉄硫黄クラスターは、蛋白質表面上で部分的に露出していて、鉄硫黄クラスターの受け渡しに実に都合の良い構造をしていることが明らかになりました。
さらに、別の蛋白質へと受け渡されなければならないため、その鉄硫黄クラスターの結合様式に大変興味が持たれていました。私たちの研究室では、蛋白研山下博士・月原教授グループとの共同研究で、IscA という足場蛋白質に結合した鉄硫黄クラスターの立体構造を世界に先駆けて決定し Journal of Molecular Biology に報告しています。明らかになった構造では(上図左側)、鉄硫黄クラスターは、蛋白質表面上で部分的に露出していて、鉄硫黄クラスターの受け渡しに実に都合の良い構造をしていることが明らかになりました。
尚、大学院入学方法などに関する詳細は、メール もしくは こちら からお問い合わせください。